PD-L1 тестування та оцінювання
PD-L1 тестування та оцінювання
Основна інформація про визначення статусу експресії PD-L1
Статус експресії PD-L1 визначається по-різному, залежно від типу раку. Статус експресії PD-L1 оцінюють за допомогою двох показників – комбінованого позитивного показника (CPS) і показника пропорції пухлини (TPS), які допомагають ідентифікувати пацієнтів, яким з найбільшою ймовірністю допоможе лікування КІТРУДОЮ1.
На цій сторінці наводиться така інформація:
Визначення статусу експресії PD-L1
Статус цього біомаркера може визначати персоналізацію лікування
CPS (комбінований позитивний показник)1
CPS використовується для оцінки статусу експресії PD-L1 при таких злоякісних пухлинах:
- Метастатичний або неоперабельний рецидивуючий плоскоклітинний рак голови та шиї (HNSCC)
- Рак шлунку
- Езофагеальний рак
- Розповсюджений рак шийки матки
- Розповсюджений тричі негативний рак молочної залози
Визначення CPS
За допомогою цього показника визначається кількість PD-L1-забарвлених клітин (пухлинних клітин, лімфоцитів, макрофагів) відносно кількості всіх життєздатних пухлинних клітин.
Розрахунок CPS
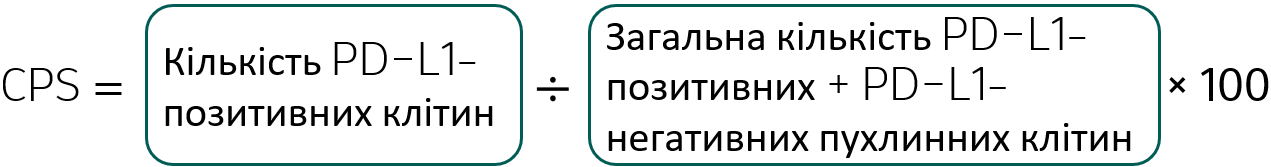
Інтерпретація результатів визначення CPS
Незважаючи на те, що результат розрахунку CPS може перевищувати 100, максимальний результат визначення CPS позначається як 100.
Зразок пухлинної тканини вважається адекватним для оцінки статусу експресії PD-L1, якщо у PD-L1-забарвленому мікроскопічному препараті міститься мінімум 100 життєздатних пухлинних клітин.
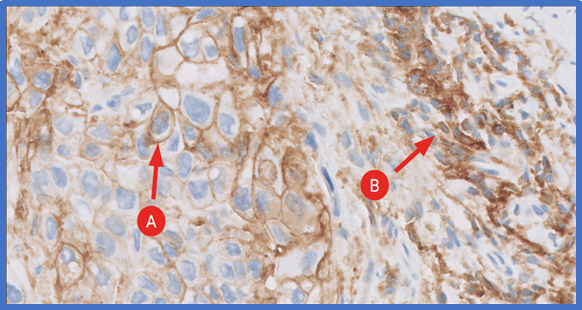
A – пухлинна клітина, B – імунна клітина
TPS (показник пропорції пухлини)
TPS використовується для оцінки статусу експресії PD-L1 при таких злоякісних пухлинах:
- Розповсюджений недрібноклітинний рак легенів (NSCLC)
Визначення TPS
За допомогою цього показника визначається відносна кількість життєздатних пухлинних клітин із частковим або повним забарвленням мембрани будь-якої інтенсивності.
Розрахунок TPS
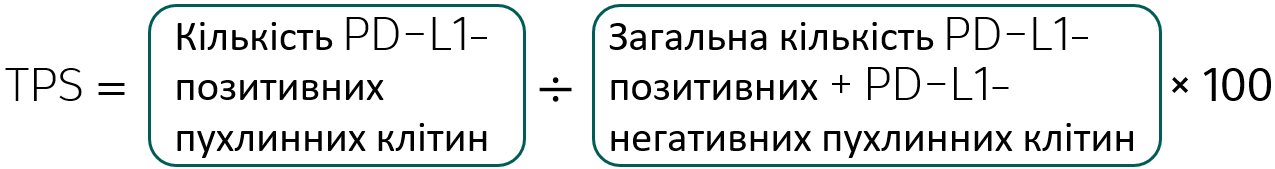
Інтерпретація результатів визначення TPS
Ступінь експресії PD-L1 при розповсюдженому недрібноклітинному раку легенів визначається за допомогою показника ТPS, який розраховується на шкалі від 0% до 100%.
Зразок пухлинної тканини вважається адекватним для оцінки статусу експресії PD-L1, якщо у PD-L1-забарвленому мікроскопічному препараті міститься мінімум 100 життєздатних пухлинних клітин.
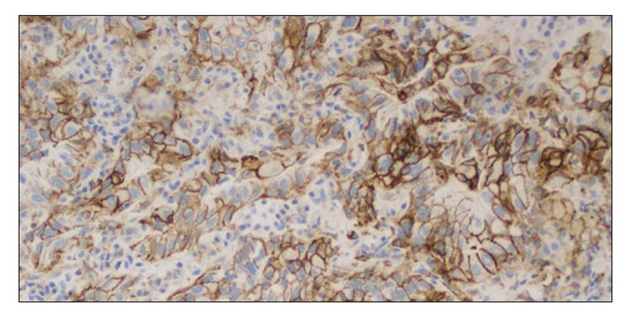
Зразок NSCLC, забарвлений антитілом до PD-L1, величина TPS становить ≥50%
PD-L1 = ліганд 1 білка запрограмованої загибелі клітин; HNSCC = плоскоклітинний рак голови та шиї; NSCLC = недрібноклітинний рак легенів
Показання для Кітруда, при яких необхідно проводити PD-L1 тестування
Недрібноклітинний рак легень (NSCLC)
Перша лінія монотерапії для неплоскоклітинного та плоскоклітинного недрібноклітинного раку легень (non-small cell lung cancer, NSCLC)
Препарат Кітруда® як монотерапія показаний як препарат першої лінії для пацієнтів з NSCLC, коли пухлини експресують PD-L1 [Tumor Proportion Score (TPS) ≥ 1 %], що підтверджено валідованим тестом при відсутності мутацій в гені EGFR або ALK та у разі:
- III стадії, якщо пацієнтам не показана хірургічна резекція або остаточна хіміопроменева терапія, або
- метастатичного захворювання
TPS ≥ 1%
Друга чи наступна лінії монотерапії для неплоскоклітинного та плоскоклітинного недрібноклітинного раку легень (non-small cell lung cancer, NSCLC)
Препарат Кітруда® як монотерапія показаний для лікування пацієнтів з метастатичним NSCLC у разі, коли пухлини експресують PD-L1 (TPS ≥ 1 %), що підтверджено валідованим тестом, у разі прогресування захворювання під час або після платиновмісної хіміотерапії. Для пацієнтів з EGFR або ALK геномними абераціями, Кітруда® може призначатися після прогресії на таргетній терапії у відповідності зі стандартами терапії зазначених аберацій.
TPS ≥ 1%
Плоскоклітинний рак голови та шиї (head and neck squamous cell cancer, HNSCC)
Препарат Кітруда® як монотерапія показаний як препарат першої лінії для пацієнтів з метастатичним або нерезектабельним, рецидивуючим HNSCC, коли пухлини експресують PD-L1 [Combinen Positive Score (CPS) ≥ 1], що підтверджено валідованим тестом.
CPS ≥ 1%
Езофагеальний рак
Препарат Кітруда® показаний для лікування пацієнтів з місцево прогресуючою або метастатичною карциномою стравоходу або гастроезофагеального з’єднання (GEJ) (центр пухлини розташований на 1–5 см вище GEJ), що не піддається хірургічній резекції або остаточному хіміопроменевому лікуванню:
• у комбінації з хіміотерапією на основі платини або фторпіримідину або
• як монотерапія після однієї або декількох попередніх ліній системної терапії для пацієнтів з пухлинами плоскоклітинної гістології, коли пухлини експресують PD-L1 (CPS ≥ 10), що підтверджено валідованим тестом.
CPS ≥ 10%
тільки для 2L монотерапії
Рак шийки матки
Препарат Кітруда® в поєднанні з хіміотерапією, з бевацизумабом або без нього, показаний для лікування пацієнтів із персистуючим, рецидивуючим або метастатичним раком шийки матки, у яких пухлини експресують PD-L1 (CPS ≥ 1), що підтверджено валідованим тестом. Препарат Кітруда® як монотерапія показаний для лікування пацієнтів з рецидивуючим або метастатичним раком шийки матки у разі прогресування цього захворювання під час або після хіміотерапії, коли пухлини експресують PD-L1 (CPS ≥ 1), що підтверджено валідованим тестом.
Препарат Кітруда® як монотерапія показаний для лікування пацієнтів з рецидивуючим або метастатичним раком шийки матки у разі прогресування цього захворювання під час або після хіміотерапії, коли пухлини експресують PD-L1 (CPS ≥ 1), що підтверджено валідованим тестом
CPS ≥ 1%
Тричі негативний рак грудної залози
Препарат Кітруда® у поєднанні з хіміотерапією показаний для лікування пацієнтів з місцево рецидивуючим нерезектабельним або метастатичним тричі негативним раком грудної залози (triple-negative breast cancer, TNBC), коли пухлини експресують PD-L1 (CPS ≥ 10), що підтверджено валідованим тестом
CPS ≥ 10%
Вам може бути також цікаво
Показання2
Препарат Кітруда® показаний для лікування пацієнтів з нерезектабельною або метастатичною меланомою.
Препарат Кітруда® показаний для адї’ювантної терапії дорослих та дітей (віком від 12 років) з меланомою стадій IIB, IIC або III після повної резекції.
Препарат Кітруда® у комбінації з хіміотерапією пеметрекседом і препаратом платини показаний як препарат першої лінії для пацієнтів з метастатичним неплоскоклітинним недрібноклітинним раком легень (non-small cell lung cancer, NSCLC) при відсутності мутацій в гені епідермального фактора росту (EGFR) або кінази анапластичної лімфоми (ALK).
Препарат Кітруда® у комбінації з карбоплатином та паклітакселом або паклітакселом, зв’язаним з білком, показаний як препарат першої лінії для пацієнтів з метастатичним плоскоклітинним NSCLC.
Препарат Кітруда® як монотерапія показаний як препарат першої лінії для пацієнтів з NSCLC, коли пухлини експресують PD-L1 [Tumor Proportion Score (TPS) ≥ 1 %], що підтверджено валідованим тестом, при відсутності мутацій в гені EGFR або ALK та у разі:
- III стадії, якщо пацієнтам не показана хірургічна резекція або остаточна хіміопроменева терапія, або
- метастатичного захворювання.
Препарат Кітруда® як монотерапія показаний для лікування пацієнтів з метастатичним NSCLC у разі, коли пухлини експресують PD-L1 (TPS ≥ 1 %), що підтверджено валідованим тестом, у разі прогресування захворювання під час або після платиновмісної хіміотерапії. Для пацієнтів з EGFR або ALK геномними абераціями Кітруда® може призначатися після прогресії на таргетній терапії у відповідності зі стандартами терапії зазначених аберацій.
Препарат Кітруда® показаний для лікування пацієнтів з резектабельним NSCLC (пухлини ≥ 4 см або позитивні за статусом ураження лімфатичних вузлів) у комбінації з платиновмісною хіміотерапією як неоадÂ’ювантне лікування та з подальшим продовженням як монотерапії для ад’ювантного лікування після хірургічного втручання.
Препарат Кітруда® як монотерапія показаний для ад’ювантного лікування після резекції та платиновмісної хіміотерапії дорослим пацієнтам з NSCLC стадії IB (T2a ≥ 4 см), II або IIIA.
Препарат Кітруда® у комбінації з платиною та фторурацилом (ФУ) показаний як терапія першої лінії для пацієнтів з метастатичним або нерезектабельним, рецидивуючим плоскоклітинним раком голови та шиї (head and neck squamous cell cancer, HNSCC).
Препарат Кітруда® як монотерапія показаний як препарат першої лінії для пацієнтів з метастатичним або нерезектабельним, рецидивуючим HNSCC, коли пухлини експресують PD-L1 [Combined Positive Score (CPS) ≥ 1], що підтверджено валідованим тестом.
Препарат Кітруда® показаний як монотерапія для лікування пацієнтів з рецидивуючим чи метастатичним HNSCC, що прогресує при проведенні чи після проведення хіміотерапії з препаратами платини.
Препарат Кітруда® показаний для лікування дорослих з рецидивуючою або рефрактерною класичною лімфомою Ходжкіна (classical Hodgkin lymphoma, cHL).
Препарат Кітруда® призначений для лікування дітей з рефрактерною cHL або з рецидивом cHL після 2 або більше ліній терапії.
Первинна медіастинальна В-крупноклітинна лімфома
Препарат Кітруда® показаний для лікування дорослих та дітей із рефрактерною первинною медіастинальною В-крупноклітинною лімфомою (primary mediastinal large B-cell lymphoma, PMBCL) або при її рецидиві після проведення 2 або більше ліній попередньої терапії.
Обмеження застосування: препарат Кітруда® не рекомендується для лікування пацієнтів з PMBCL, які потребують термінової циторедуктивної терапії.
Препарат Кітруда® у комбінації з енфортумабом ведотином показаний для лікування дорослих пацієнтів з місцево поширеним або метастатичним уротеліальним раком.
Препарат Кітруда® як монотерапія показаний для лікування пацієнтів з місцево поширеною або метастатичною уротеліальною карциномою:
- яким не показана будь-яка платиновмісна хіміотерапія або
- у яких спостерігається прогресування захворювання при проведенні чи після завершення платиновмісної хіміотерапії або протягом 12 місяців неоадÂ’ювантної або адÂ’ювантної платиновмісної хіміотерапії.
Препарат Кітруда® як монотерапія показаний для лікування пацієнтів з раком сечового міхура високого ризику без проростання у м’язову стінку при неефективності терапії БЦЖ (бацилою Кальметта – Герена), з карциномою in situ з папілярними пухлинами або без них, які не підлягають (або не згодні на) проведення цистектомії.
Препарат Кітруда® показаний для лікування дорослих і дітей з нерезектабельними або метастатичними солідними пухлинами, з високою мікросателітною нестабільністю (microsatellite instability-high cancer, MSI-H) або дефіцитом механізмів репарації (mismatch repair deficient, dMMR), що підтверджено валідованим тестом, що прогресували при попередньому лікуванні, а також при відсутності вибору альтернативного лікування.
Препарат Кітруда® показаний для лікування пацієнтів з нерезектабельним або метастатичним колоректальним раком (colorectal cancer, CRC) з високою мікросателітною нестабільністю (MSI-H) або дефіцитом механізмів репарації (dMMR), що підтверджено валідованим тестом.
Препарат Кітруда® у комбінації з трастузумабом, фторпіримідин- та платиновмісною хіміотерапією показаний як перша лінія лікування дорослих з місцево поширеною нерезектабельною або метастатичною HER2-позитивною аденокарциномою шлунка або гастроезофагеального з’єднання (gastroesophageal junction, GEJ), коли пухлини експресують PD-L1 [Combined Positive Score (CPS) ≥ 1], що підтверджено валідованим тестом.
Препарат Кітруда® у комбінації з фторпіримідин- та платиновмісною хіміотерапією показаний як перша лінія лікування дорослих з місцево поширеною нерезектабельною або метастатичною HER2-негативною аденокарциномою шлунка або гастроезофагеального з’єднання (GEJ).
Препарат Кітруда® показаний для лікування пацієнтів з місцево поширеною або метастатичною карциномою стравоходу або гастроезофагеального з’єднання (GEJ) (центр пухлини розташований на 1–5 см вище GEJ), що не піддається хірургічній резекції або остаточному хіміопроменевому лікуванню:
- у комбінації з хіміотерапією на основі платини або фторпіримідину або
- як монотерапія після однієї або декількох попередніх ліній системної терапії для пацієнтів з пухлинами плоскоклітинної гістології, коли пухлини експресують PD-L1 (CPS ≥ 10), що підтверджено валідованим тестом.
Препарат Кітруда® у комбінації з хіміопроменевою терапією показаний для лікування пацієнтів з раком шийки матки стадії III–IVA за FIGO 2014.
Препарат Кітруда® у комбінації з хіміотерапією, з бевацизумабом або без нього, показаний для лікування пацієнтів із персистуючим, рецидивуючим або метастатичним раком шийки матки, у яких пухлини експресують PD-L1 (CPS ≥ 1), що підтверджено валідованим тестом. Препарат Кітруда® як монотерапія показаний для лікування пацієнтів з рецидивуючим або метастатичним раком шийки матки у разі прогресування цього захворювання під час або після хіміотерапії, коли пухлини експресують PD-L1 (CPS ≥ 1), що підтверджено валідованим тестом.
Препарат Кітруда® показаний для лікування пацієнтів з гепатоцелюлярною карциномою (hepatocellular carcinoma, HCC), вторинною відносно гепатиту В, які отримували попередню системну терапію, відмінну від схеми, що містить PD-1/PD-L1.
Препарат Кітруда® у комбінації з гемцитабіном та цисплатином показаний для лікування пацієнтів з місцево поширеним нерезектабельним або метастатичним раком жовчовивідних шляхів (biliary tract cancer, ВТС).
Препарат Кітруда® показаний для лікування дорослих і дітей з рецидивуючою місцево поширеною або метастатичною карциномою клітин Меркеля (Merkel cell carcinoma, MCC).
Препарат Кітруда® у комбінації з акситинібом показаний як препарат першої лінії для лікування дорослих з поширеним нирково-клітинним раком (renall cell carcinoma, RCC).
Препарат Кітруда® показаний для адÂ’ювантної терапії пацієнтів з RCC із помірно високим або високим ризиком рецидиву після нефректомії або після нефректомії та резекції метастатичних уражень.
Препарат Кітруда® у комбінації з карбоплатином і паклітакселом, з подальшим застосуванням препарату Кітруда® як монотерапії, показаний для лікування дорослих пацієнтів з первинною поширеною або рецидивуючою карциномою ендометрія.
Препарат Кітруда® як монотерапія показаний для лікування дорослих пацієнтів із поширеною карциномою ендометрія, яка є MSI-H або dMMR, що підтверджено валідованим тестом, у яких спостерігається прогресування захворювання після попередньої системної терапії в будь-яких умовах і які не підлягають хірургічному лікуванню або опроміненню (див. розділ «Спосіб застосування та дози»).
Препарат Кітруда® показаний для лікування дорослих та дітей з нерезектабельними або метастатичними солідними пухлинами з високим мутаційним навантаженням (tumor mutational burden-high, TMB-H) [≥ 10 мутацій на 1 мегабазу (мут/Мб)], що підтверджено валідованим тестом (див. розділ «Спосіб застосування та дози»), у яких прогресування спостерігалося після попереднього лікування і для яких відсутні задовільні альтернативні варіанти лікування. Обмеження застосування: безпеку та ефективність застосування препарату Кітруда® дітям з раком центральної нервової системи TMB-H не встановлено.
Препарат Кітруда® показаний для лікування пацієнтів з рецидивуючою або метастатичною плоскоклітинною карциномою шкіри (cutaneous squamous cell carcinoma, cSCC) або місцево прогресуючою cSCC, яка не піддається хірургічному чи променевому лікуванню.
Препарат Кітруда® показаний для лікування пацієнтів з тричі негативним раком грудної залози (triple-negative breast cancer, TNBC) ранніх стадій високого ризику в поєднанні з хіміотерапією в якості неоад’ювантної терапії та з подальшим застосуванням в якості ад’ювантної монотерапії після хірургічного втручання.
Препарат Кітруда® у поєднанні з хіміотерапією показаний для лікування пацієнтів з місцево рецидивуючим нерезектабельним або метастатичним TNBC, коли пухлини експресують PD-L1 (CPS ≥ 10), що підтверджено валідованим тестом (див. розділ «Спосіб застосування та дози»).
- Agilent Technologies, Inc. Instructions for Use: PD-L1 IHC 22C3 pharmDx. https://www.agilent.com/cs/library/usermanuals/public/29314_22c3_pharmDx_hnscc_interpretation_manual_us.pdf
- Інструкція для медичного застосування лікарського засобу Кітруда, РП UA/16209/01/01, Наказ МОЗ №787 від 08.05.2025,Термін дії реєстраційного посвідчення: до 02.07.2027