Вакцинація дорослих людей
Більшість дорослих чоловіків і жінок не захищені від типів ВПЛ, на які спрямована дія вакцин проти ВПЛ1
Профілактична вакцинація проти ВПЛ в ідеалі має виконуватися в ранньому підлітковому віці до першого контакту підлітка з ВПЛ, проте у багатьох країнах поки що не досягнуте оптимальне охоплення підлітків такою вакцинацією.1
Крім того, “наздоганяюча” вакцинація у невакцинованих дорослих впроваджується непослідовно.1

У червні 2019 року ACIP (Консультативний комітет з практики імунізації США) рекомендував виконувати “наздоганяючу” вакцинацію проти ВПЛ в усіх осіб віком до 26 років включно. Для дорослих віком 27-45 років, які не отримали належні щеплення в ранньому підлітковому віці, клініцисти можуть розглянути доцільність обговорення питання вакцинації проти ВПЛ у людей, які найімовірніше отримають від цього користь.2
Чоловіки і жінки віком від 27 років або старше, у яких зберігається ризик інфікування ВПЛ, можуть отримати вакцину проти ВПЛ3

Отримання вакцини проти ВПЛ є корисним навіть після початку статевого життя, оскільки малоймовірно, щоб реципієнт вакцини був інфікований усіма типами ВПЛ, які входять до складу цієї вакцини.3
Пацієнти, які могли раніше контактувати з вірусом ВПЛ, все одно отримають користь від вакцинації проти ВПЛ, яка буде забезпечувати для них захист проти тих типів ВПЛ, з якими вони не контактували.3

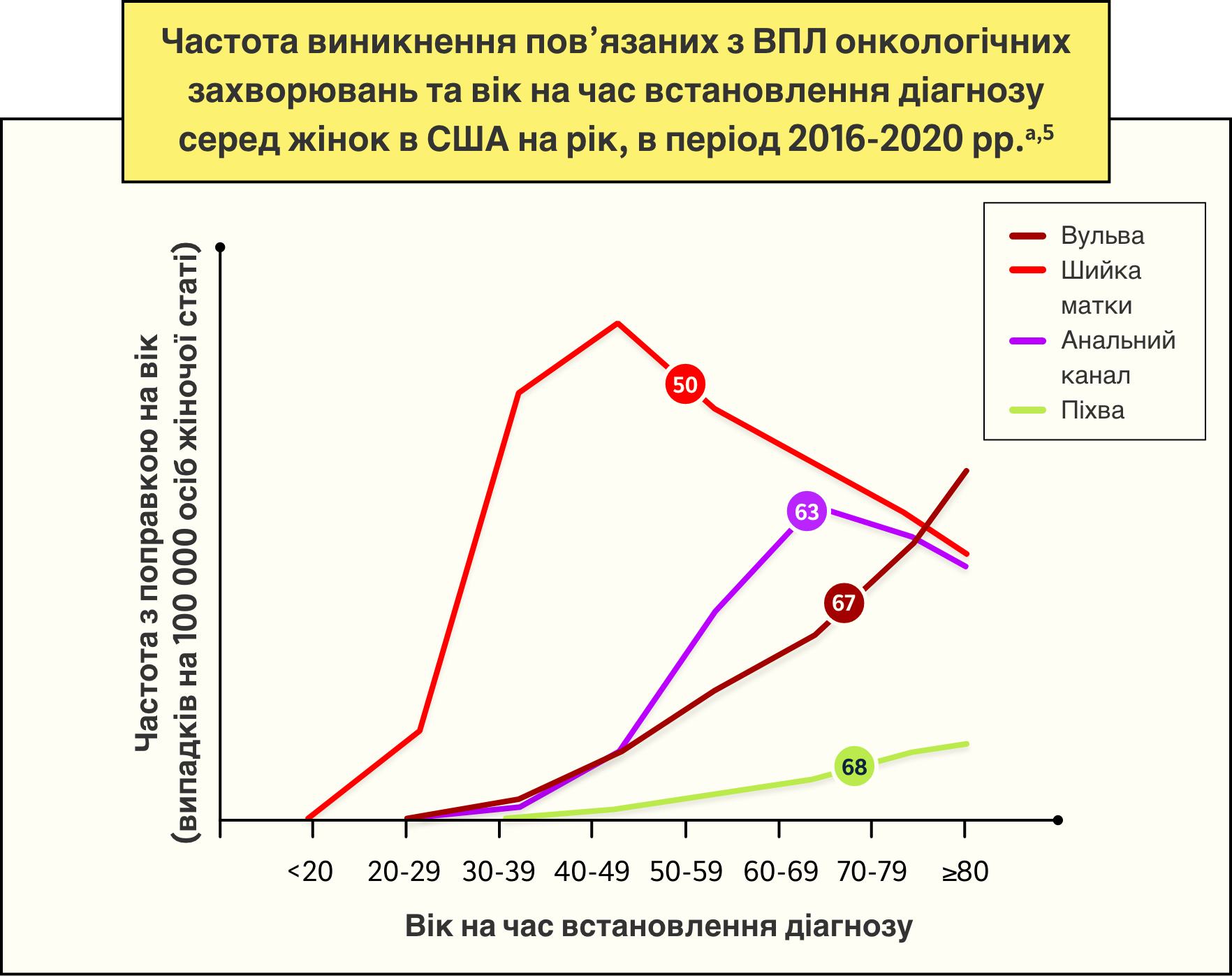
Перший пік ризику інфікування ВПЛ для жінок спостерігається у межах 5-10 років після першого сексуального контакту, після чого другий пік, що відповідає збільшенню ризику інфікування ВПЛ, відмічається у жінок віком від 45 років і старше.3
У жінок віком < 25 років:
Переважають типи ВПЛ
високого
ризику3
У жінок віком > 55 років:
Найбільш поширеними є ВПЛ
низького
ризику
і неохарактеризовані типи ВПЛ3

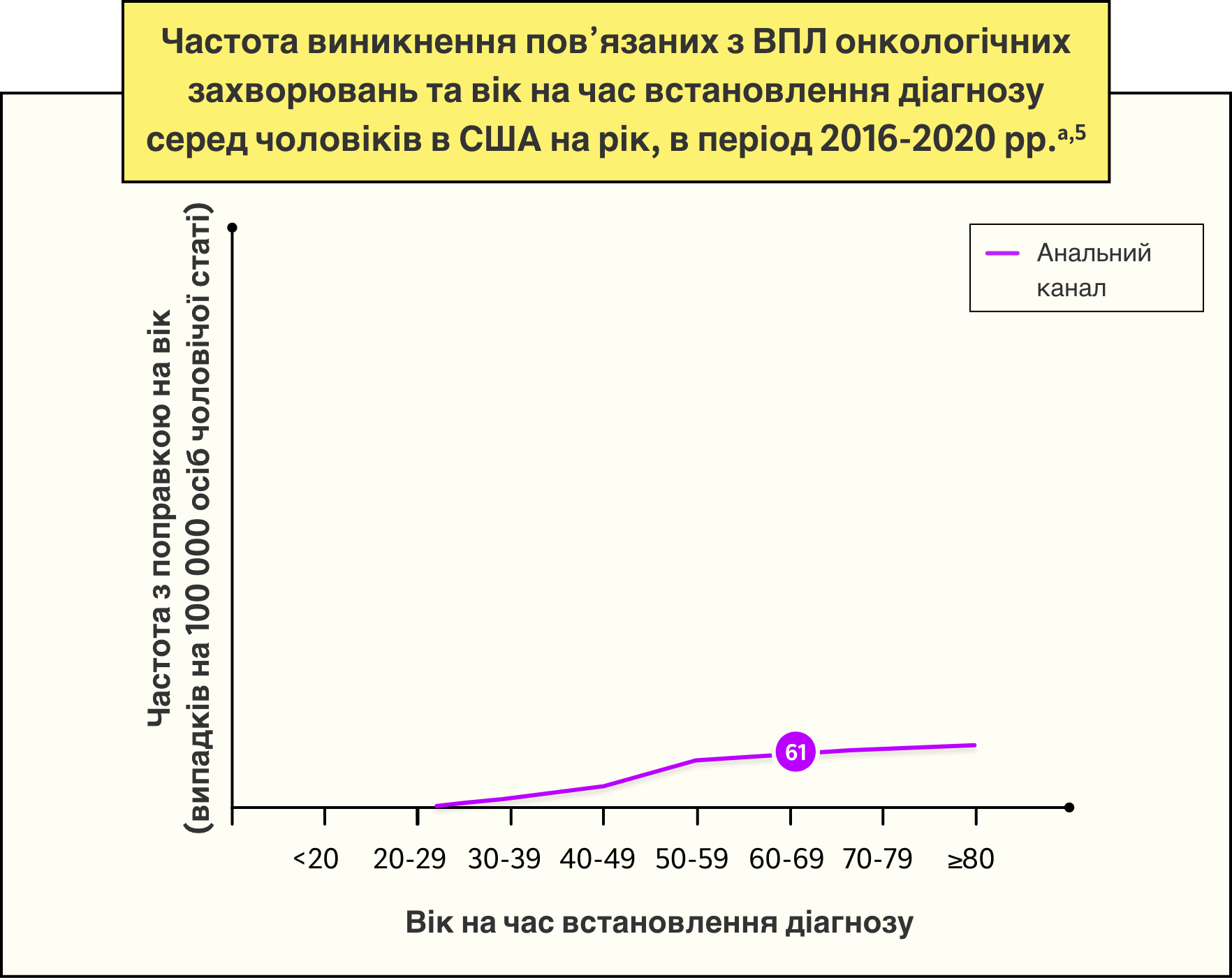
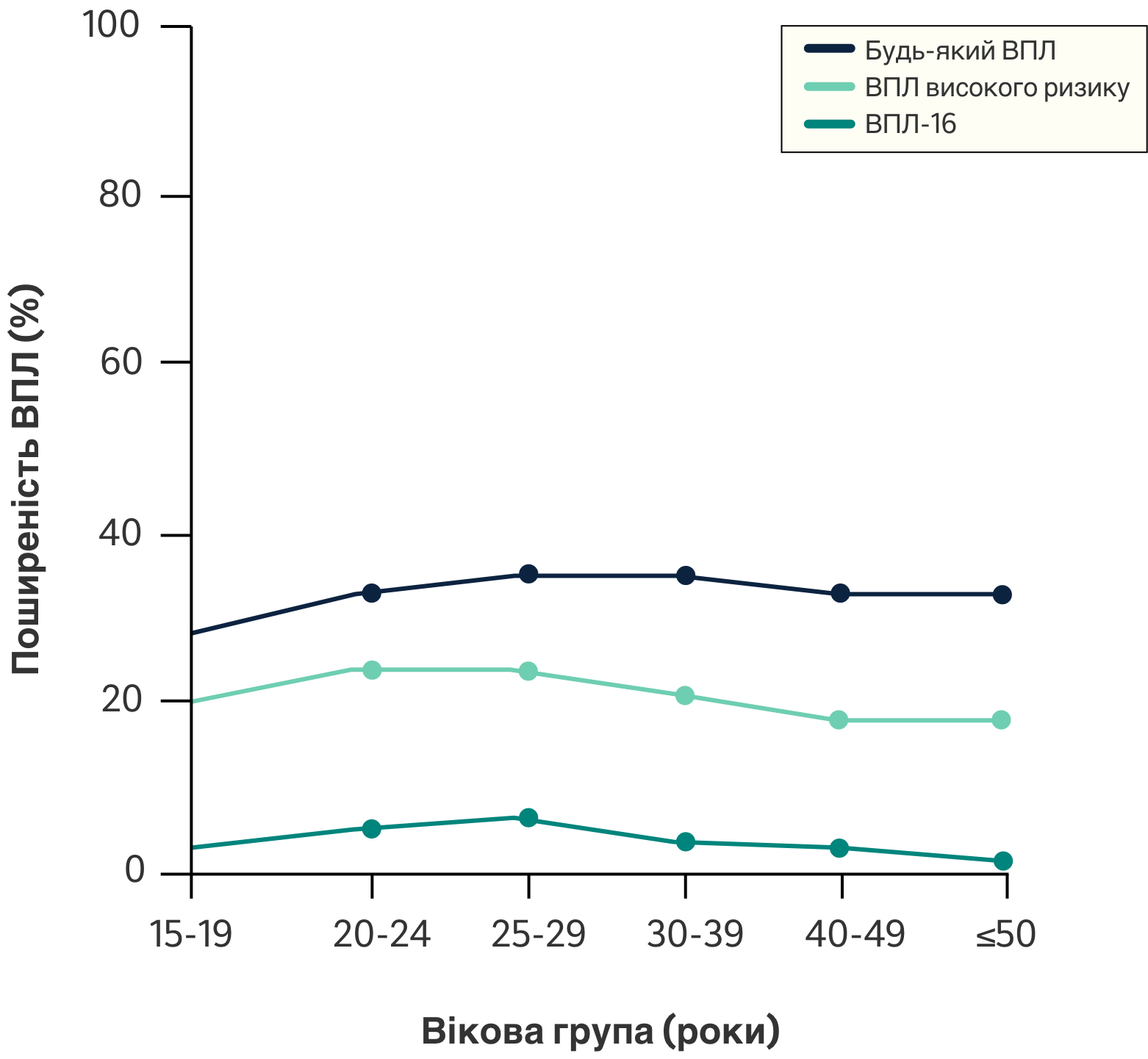
Було виявлено, що поширеність ВПЛ є високою серед чоловіків протягом всього їхнього дорослого життя і досягає свого піку у віці 25-29 років та залишається високою до принаймні 50-річного віку.4
Серед чоловіків віком 25-29 років4:
Поширеність будь-якого типу ВПЛ становила
35%
(95% ДІ: 30-41)
Поширеність типів ВПЛ високого ризику становила
24%
(95% ДІ: 19-29)
Поширеність ВПЛ 16 становила
6%
(95% ДІ: 5-9)
Щеплення проти ВПЛ у невакцинованих пацієнтів може знизити ризик інфекцій ВПЛ, які виникають у більш пізні роки життя3
Медіани віку на час встановлення діагнозу пов’язаних з ВПЛ онкологічних захворювань в США у період з 2016 по 2020 роки5
Вакцинація у дорослих людей може бути важливою для досягнення швидкого зниження частоти усіх пов’язаних з ВПЛ онкологічних і інших захворювань в усьому світі.6
Поширеність ВПЛ є високою серед чоловіків7
Молоді дорослі чоловіки і сексуально активні чоловіки незалежно від віку є важливими резервуарами статевих інфекцій ВПЛ.7

Майже 1 з 3 чоловіків в
усьому світі
(31%, 95% ДІ: 27-35)
інфікований мінімум одним з усіх типів ВПЛ7

Приблизно 1 з 5 чоловіків
(21%, 95% ДІ: 18-24)
інфікований одним або кількома з типів ВПЛ високого ризику7
Поширеність інфекції ВПЛ в залежності від віку у чоловіків7
Важливо включати чоловіків у стратегії комплексної профілактики інфекції ВПЛ з метою зниження пов’язаної з ВПЛ захворюваності і смертності у чоловіків та, зрештою, досягнення елімінації раку шийки матки та інших пов’язаних з ВПЛ захворювань.7
Вакцинація незалежно від статі забезпечує кращий захист8
Вакцинація представників обох статей забезпечує набагато кращий захист для усіх, запобігаючи передачі вірусу, зменшуючи його циркуляцію і створюючи колективний імунітет.8

У Бельгії було показано, що вакцинація незалежно від статі знижує число випадків захворювань, пов’язаних з ВПЛ типів 6/11/16/18/31/45/52/58, у порівнянні з щепленням лише жінок 9-валентними вакцинами проти ВПЛ (9вВПЛ).9
Сукупне зниження частоти захворювань, пов’язаних з ВПЛ типів 6/11/16/18/31/45/52/58, при вакцинації незалежно від статі вакциною 9вВПЛ у порівнянні з національною вакцинацією лише жінок вакциною 9вВПЛ протягом 100-річного періоду часу9
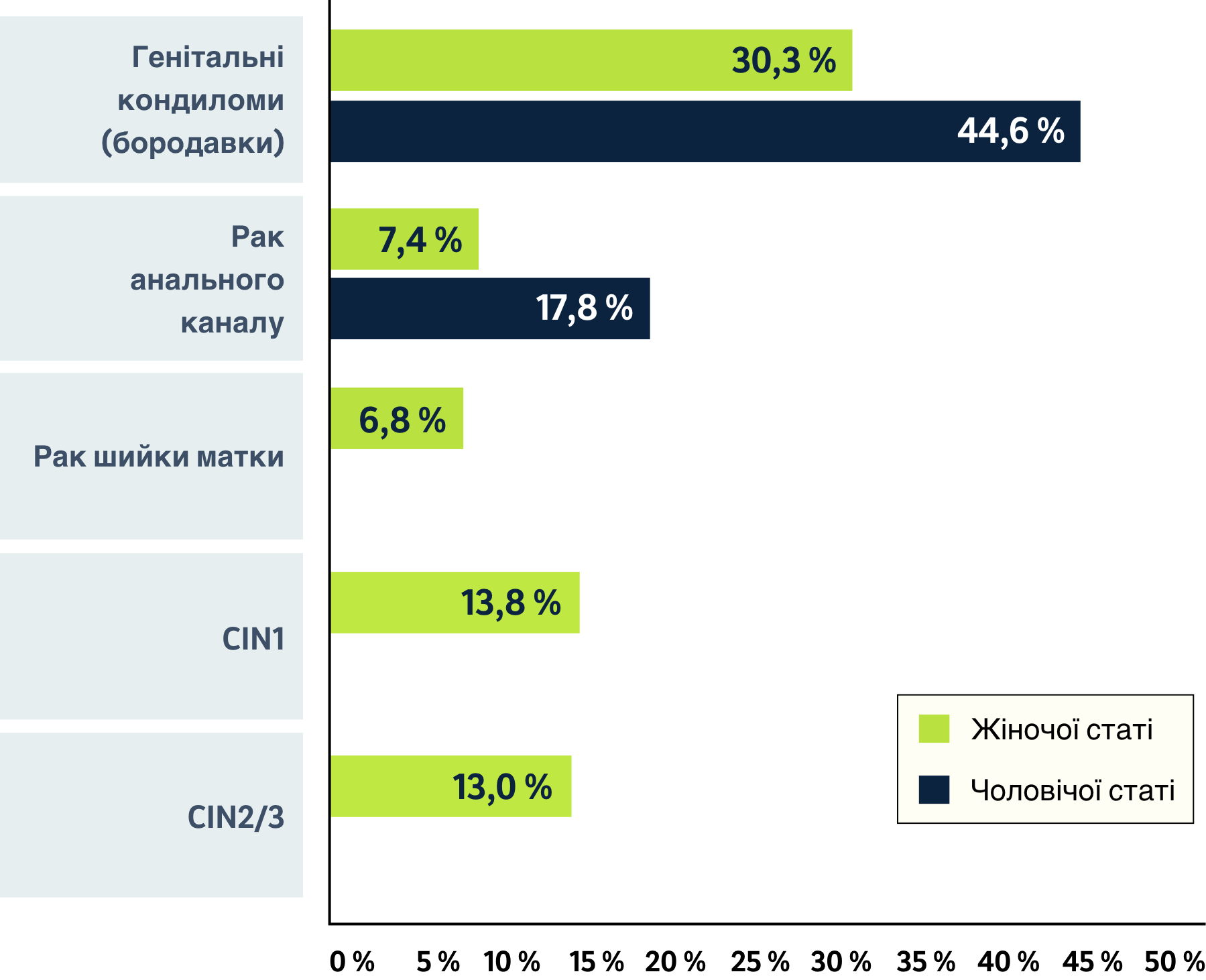
Адаптовано зі статті Simoens et al., Health Impact and Cost-Effectiveness of Implementing Gender-Neutral Vaccination With the 9-Valent Human Papillomavirus Vaccine in Belgium, 2021.
Використовувалася валідована динамічна модель передачі ВПЛ різних типів для оцінки впливу на здоров’я і економічний вплив програми вакцинації (9вВПЛ) незалежно від статі у порівнянні з різними регіональними (Фландрія: вакцина 9вВПЛ у віці 12-13 років; Валлонія-Брюссель: 2вВПЛ у віці 13-14 років) і національними (національна програма “наздоганяючої” вакцинації: вакцина 9вВПЛ у віці 12-18 років) програмами щеплення в Бельгії. Ця модель оцінювала сукупну частоту пов’язаних з ВПЛ захворювань, асоційованих з тими типами ВПЛ, на які діє вакцина 9вВПЛ; кількість випадків пов’язаних з ВПЛ захворювань, яким вдалося запобігти; кількість випадків пов’язаної з ВПЛ смерті, яким вдалося запобігти; сукупні витрати на медичну допомогу у зв’язку з пов’язаними з ВПЛ захворюваннями; кількість років життя з поправкою на якість життя в популяції, яка оцінювалася в цій моделі; та інкрементні показники “витрати/ефективність”.9
Умовні скорочення:
2вВПЛ = 2-валентна вакцина проти вірусу папіломи людини
9вВПЛ = 9-валентна вакцина проти вірусу папіломи людини
ACIP = Консультативний комітет з практики імунізації США
ДІ = довірчий інтервал
CIN1 = цервікальна інтраепітеліальна неоплазія ступеня 1
CIN2 = цервікальна інтраепітеліальна неоплазія ступеня 2
CIN3 = цервікальна інтраепітеліальна неоплазія ступеня 3
ВПЛ = вірус папіломи людини
СПИСОК ЛІТЕРАТУРИ
- Maldonado I, Plata M, Gonzalez M, et al. Effectiveness, immunogenicity, and safety of the quadrivalent HPV vaccine in women and men aged 27-45 years. Hum Vaccin Immunother. 2022;18(5):2078626.
- Meites E, Szilagyi P, Chesson HW, Unger ER, Romero JR, Markowitz LE. Papillomavirus Vaccination for Adults: Updated Recommendations of the Advisory Committee on Immunization Practices. MMWR. Morbidity and mortality weekly report. 2019;68(32):698-702.
- Government of Canada. Human papillomavirus (HPV) vaccines: Canadian Immunization Guide. https://www.canada.ca/en/ public-health/services/publications/healthy-living/canadian-immunization-guide-part-4-active-vaccines.html Accessed March 10, 2025.
- Bruni L, Albero G, Rowley J, et al. Global and regional estimates of genital human papillomavirus prevalence among men: a systematic review and meta-analysis. Lancet Glob Health. 2023:11:e1345-1362.
- Centers for Disease Control and Prevention. HPV and Cancer. HPV-Associated Cancer Diagnosis by Age. https:// www.cdc.gov/cancer/hpv/statistics/age.htm Accessed March 10, 2025.
- Maldonado I, Plata M, Gonzalez M, et al. Effectiveness, immunogenicity, and safety of the quadrivalent HPV vaccine in women and men aged 27-45 years. Hum Vaccin Immunother. 2022;18(5):2078626.
- Bruni L, Albero G, Rowley J, et al. Global and regional estimates of genital human papillomavirus prevalence among men: a systematic review and meta-analysis. Lancet Glob Health. 2023:11:e1345-1362.
- European Cancer Organisation. Action Area 1: HPV Prevention Via Gender Neutral Vaccination Programmes. https:// www.europeancancer.org/2-standard/107-hpv-action-area-1-hpv-prevention-via-gender-neutral-vaccination-programmes Accessed March 10, 2025.
- Simoens S, Bento-Abreu A, Merckx B, et al. Health Impact and Cost-Effectiveness of Implementing Gender-Neutral Vaccination With the 9-Valent Human Papillomavirus Vaccine in Belgium. Front Pharmacol. 2021;12:628434.
Додаткова інформація по темі

Ключова інформація з безпеки
Гардасил® 9 являє собою ад’ювантну неінфекційну рекомбінантну 9-валентну вакцину, виготовлену з високоочищених вірусоподібних часток (ВПЧ) основного капсидного білка L1 9 типів ВПЛ (6, 11, 16, 18,31, 33, 45, 52, 58).
Показання
Вакцина Гардасил® 9 показана для активної імунізації осіб віком від 9 років для попередження наступних захворювань, спричинених ВПЛ*:
- Передракові стани та рак шийки матки, вульви, піхви та анального каналу, спричинені типами ВПЛ, які входять до складу вакцини.
- Генітальні кондиломи (Condyloma acuminata), спричинені певними типами ВПЛ.
Вакцина застосовується лише з профілактичною метою і не впливає на активні ВПЛ- інфекції або встановлене клінічне захворювання.
Протипоказання
Гіперчутливість до діючих речовин або до будь-якої з допоміжних речовин. Особи з гіперчутливістю після попереднього застосування вакцини Гардасил® 9 або Гардасил не повинні отримувати Гардасил® 9.
Спосіб Застосування Та Дози
Вакцину слід вводити шляхом внутрішньом’язової ін’єкції, бажано у дельтовидний м’яз плеча або передньолатеральну ділянку верхньої частини стегна. Вакцину не можна вводити внутрішньосудинно, підшкірно або внутрішньошкірно та не слід змішувати в одному шприці з будь-якими іншими вакцинами та розчинами.
Дозування
Для осіб віком від 9 до 14 років включно на момент першої ін’єкції можна застосовувати за схемою із двох доз (0, 6–12 місяців). Другу дозу слід вводити у період від 5 до 13 місяців після першої дози. Якщо другу дозу вакцини вводять раніше, ніж через 5 місяців після першої дози, то завжди слід ввести третю дозу. Гардасил® 9 можна застосовувати за трьохдозовою схемою (0, 2, 6 місяців). Другу дозу слід вводити не раніше, ніж через один місяць після першої дози, а третю дозу – не раніше, ніж через 3 місяці після другої дози. Всі три дози слід ввести протягом 1 року.
Особи віком 15 років і старше на момент першої ін’єкції – Гардасил® 9 слід застосовувати за трьохдозовою схемою (0, 2, 6 місяців). Другу дозу слід вводити не раніше, ніж через один місяць після першої дози, а третю дозу – не раніше, ніж через 3 місяці після другої дози. Всі три дози слід ввести протягом 1 року.
Особам, які отримали першу дозу вакцини Гардасил® 9, рекомендовано завершити повний курс щеплення
вакциною Гардасил® 9 .Необхідність застосування бустерної дози не встановлена.
Найбільш Поширені Побічні Реакції
побічні реакції у місці ін’єкції та головний біль , які, зазвичай, були легкої або помірної інтенсивності. Частота побічних реакцій встановлена як: дуже часті (≥ 1/10): головний біль, біль у місці ін’єкції, набряк, еритема; часті (від ≥ 1/100 до < 1/10): запаморочення, свербіж, гематома у місці ін’єкції, нудота, підвищена температура, стомлюваність.
Особливі Заходи Безпеки Та Особливості Застосування
Якщо у пацієнта відзначається тяжке гостре фебрильне захворювання, то введення вакцини слід відкласти. Як і у разі застосування всіх ін’єкційних вакцин, слід забезпечити набір відповідних лікарських засобів та нагляд на випадок розвитку рідкісних анафілактичних реакцій після введення вакцини. Синкопе (непритомність), що іноді супроводжується падінням, може виникати після або навіть перед будь-якою вакцинацією, особливо у підлітків, як психогенна відповідь на ін’єкцію голкою та може супроводжуватися кількома неврологічними ознаками, наприклад тимчасовим порушенням зору, парестезією та тоніко-клонічними рухами кінцівок в період відновлення стану. Тому за вакцинованими особами слід спостерігати протягом приблизно 15 хвилин після вакцинації Гардасил® 9 слід застосувати якомога швидше після вилучення з холодильника.
Перед застосуванням необхідно добре збовтати попередньо наповнений шприц для отримання суспензії та візуально перевірити суспензію на наявність механічних часток та зміни кольору. Вакцину слід застосовувати в тому вигляді, в якому вона постачається. Слід використовувати рекомендоване дозування в повному об’ємі.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Безпека та імуногенність у осіб, які отримували імуноглобулін або препарати крові протягом 3 місяців до вакцинації, в клінічних дослідженнях не вивчалися.
Застосування з іншими вакцинами: Гардасил® 9 можна вводити одночасно з комбінованою бустерною вакциною проти дифтерії і правця з кашлюковим та/або поліомієлітним [інактивованим] (IPV) компонентом. Відсутні дані про безпеку, імуногенність та ефективність, які б підтверджували взаємозамінність вакцини Гардасил® 9 з бівалентними або квадривалентними вакцинами проти ВПЛ. Застосування з гормональними контрацептивами не впливало на типоспецифічну імунну відповідь при застосуванні вакцини Гардасил® 9.
За відсутності досліджень сумісності цей лікарський засіб не слід змішувати з іншими лікарськими засобами.
Інформація Щодо Застосування Особливими Групами Населення
Діти віком ˂ 9 років: безпека та ефективність застосування вакцини Гардасил® 9 дітям віком до 9 років не встановлені. Дані відсутні.
Вагітність: недостатньо даних для того, щоб рекомендувати застосування вакцини Гардасил® 9 у період вагітності. Слід відкласти вакцинацію до завершення вагітності. Лактація: Гардасил® 9 можна застосовувати у період годування груддю.
У осіб з порушенням імунологічної реактивності внаслідок застосування потужної імуносупресивної терапії, генетичного дефекту, інфікування вірусом імунодефіциту людини (ВІЛ) чи з інших причин, реакція на вакцину може бути відсутньою. Вакцину слід з обережністю вводити пацієнтам з тромбоцитопенією або будь-якими порушеннями згортання крові через ризик розвитку кровотечі після внутрішньом’язового введення у таких пацієнтів.
Як і будь-яка інша вакцина, вакцинація вакциною Гардасил® 9 забезпечує захист не у всіх вакцинованих. Вакцина забезпечує захист лише проти захворювань, викликаних типами ВПЛ, на які спрямована вакцина.Очікується, що Гардасил® 9 забезпечує захист проти типів ВПЛ, які спричиняють приблизно: 90 % випадків раку шийки матки; більш ніж 95 % випадків аденокарциноми in situ (AIS); 75–85 % випадків внутрішньоепітеліальної неоплазії шийки матки високого ступеня градації (CIN 2/3), 85–90 % випадків раку вульви, пов’язаного з ВПЛ; 90–95 % випадків внутрішньоепітеліальної неоплазії вульви високого ступеня градації, пов’язаної з ВПЛ (VIN 2/3); 80–85 % випадків раку піхви, пов’язаного з ВПЛ; 75–85 % випадків внутрішньоепітеліальної неоплазії піхви високого ступеня градації, пов’язаної з ВПЛ (VaIN 2/3); 90–95 % випадків анального раку, пов’язаного з ВПЛ; 85–90 % випадків внутрішньоепітеліальної неоплазії анального каналу високого ступеня градації, пов’язаної з ВПЛ (AIN 2/3), та 90 % випадків генітальних кондилом.
Для повідомлення про небажані явища при застосуванні лікарських засобів компанії МСД, зателефонуйте нам +38 044 393 74 80 або напишіть pharmacovigilance.ukraine&cis@merck.com.
Реєстраційне посвідчення № UA/20128/01/01.
UA-GSL-00003 | Матеріал дійсний до: 02.2027
