Онкологічні захворювання, пов’язані з ВПЛ
Типи ВПЛ і асоційовані захворювання1
Типи ВПЛ високого ризику виявляються у 99% випадків передракових станів шийки матки1
Місце інфекції на слизових оболонках / статевих органах
Типи ВПЛ високого ризику
(16, 18, 31, 33, 45, 52, 58 та інші)
- Низько- або високодиференційовані вогнища ураження статевих шляхів
- Рак шийки матки, рак анального каналу, рак піхви, рак вульви
Типи ВПЛ низького ризику
(6, 11 та інші)
- Високодиференційовані вогнища ураження статевих шляхів
- Аногенітальні бородавки
Адаптовано за матеріалами Центрів з контролю і профілактики захворювань США (CDC). Епідеміологія і профілактика захворювань, яким можливо запобігати за допомогою вакцин. “Рожева книга”. Глава 11: Вірус папіломи людини.
Наскільки поширеними є онкологічні захворювання, асоційовані з ВПЛ?

Рак шийки матки є найпоширенішим онкологічним захворюванням, асоційованим з ВПЛ, серед жінок2
У світі загалом ВПЛ 16/18/31/33/45/52/58/6 і 11 (типи, включені у 9-валентну вакцину проти ВПЛ [9вВПЛ]) відповідають за наступні відносні частки у структурі зазначених захворювань3:
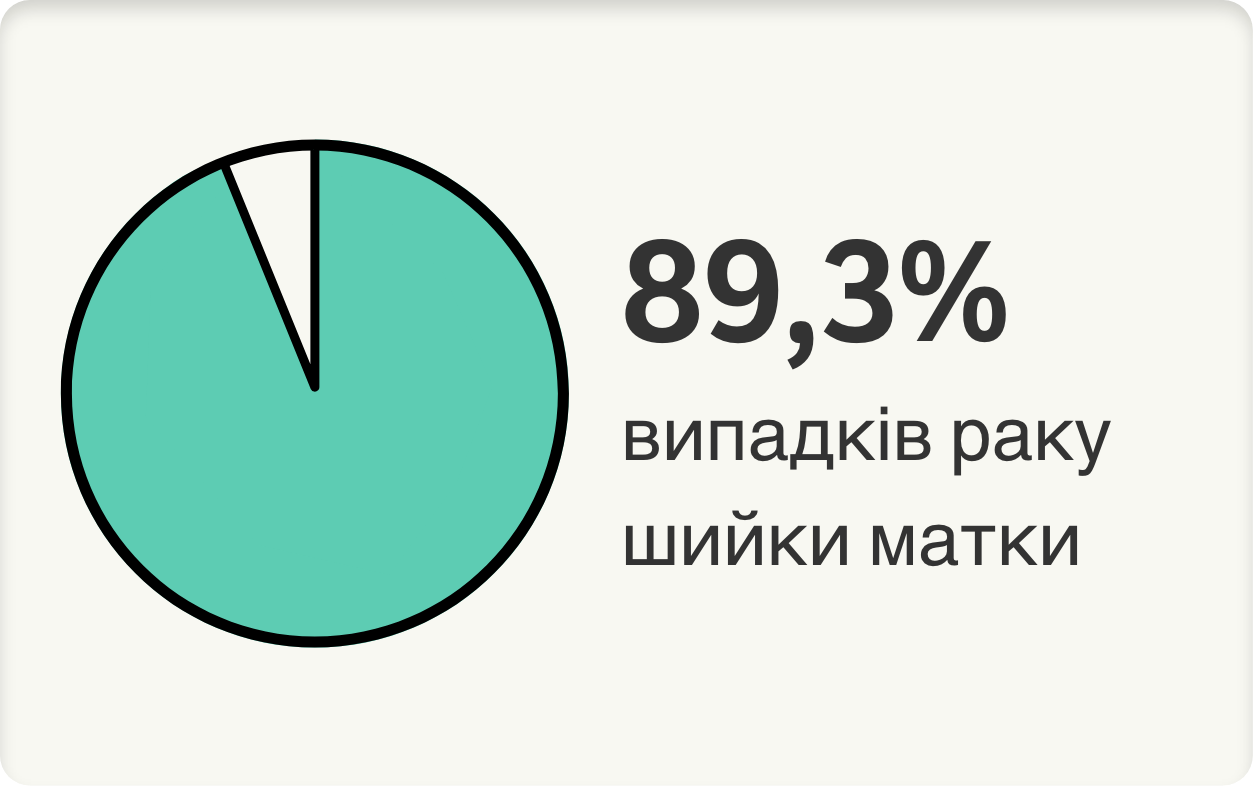

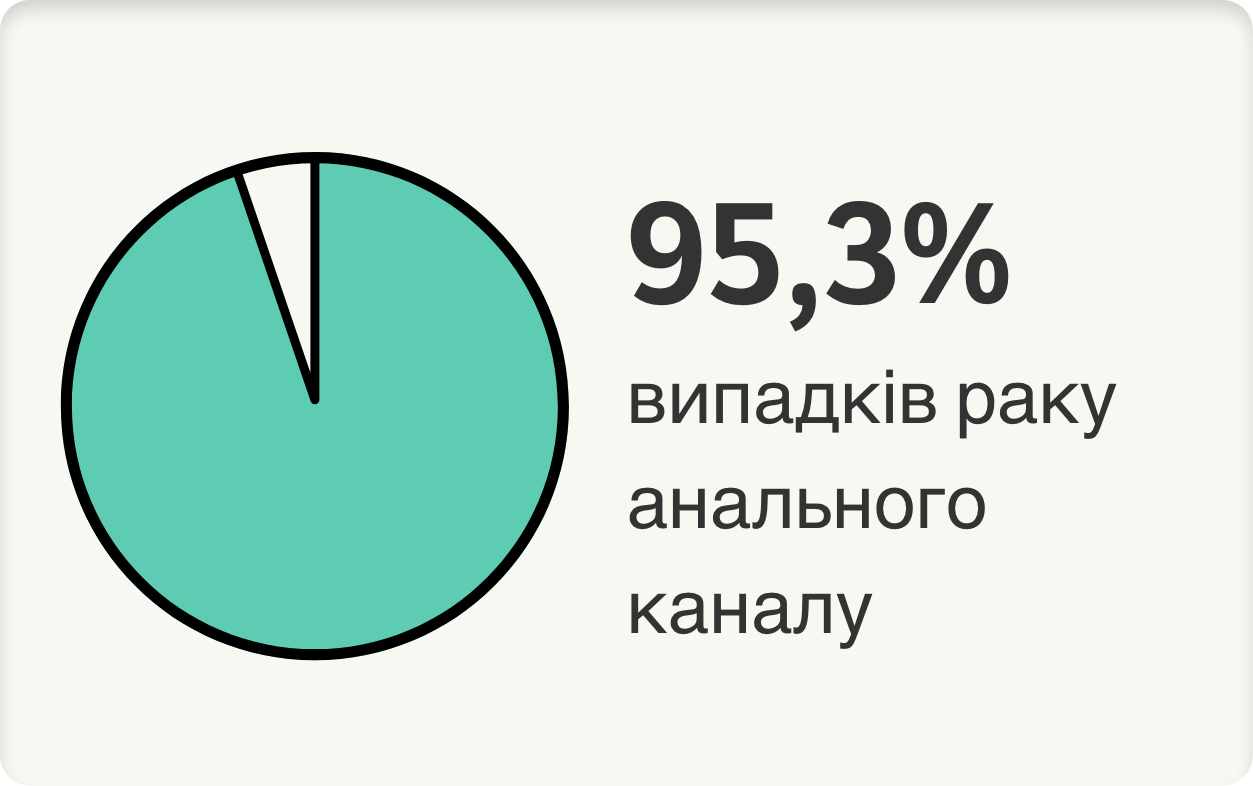
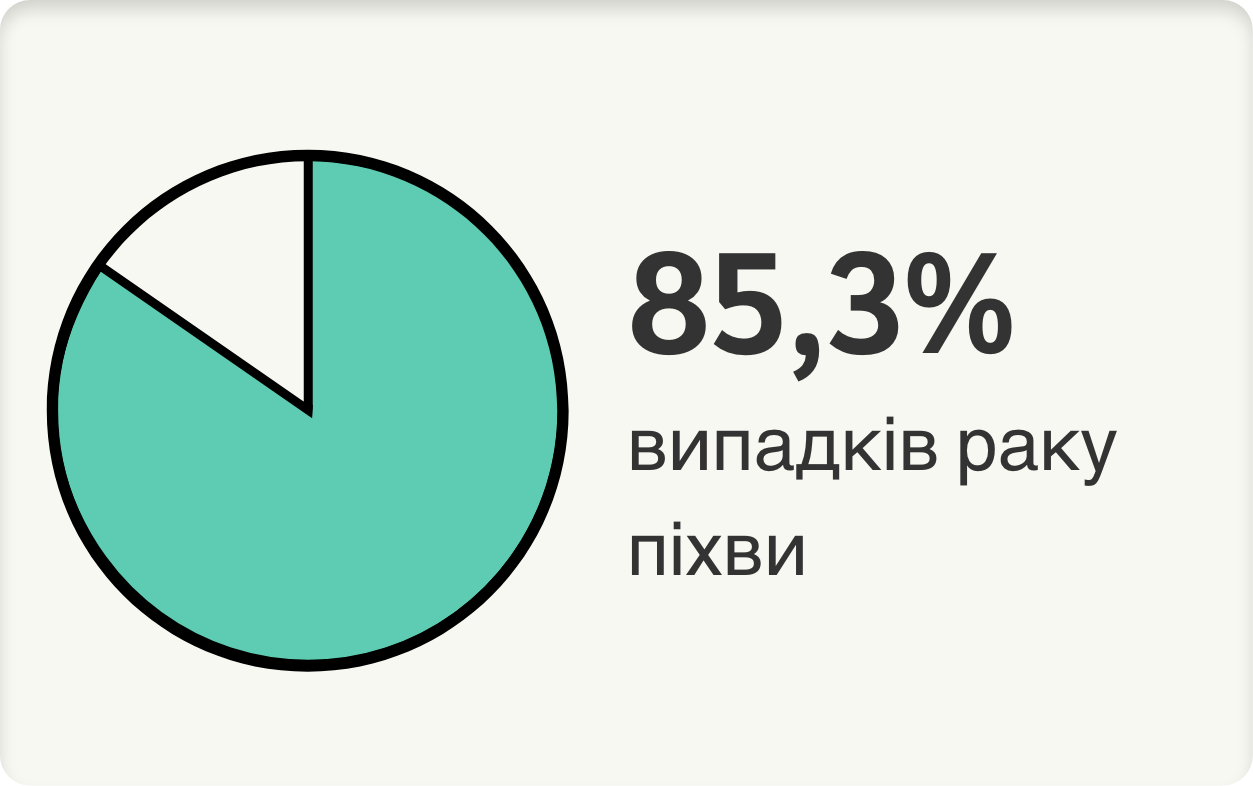
Адаптовано зі статті de Sanjosé S., et al. Burden of Human Pappilomavirus (HPV)-Related Cancers Attributable to HPVs 6/11/16/18/31/33/45/52 and 58. OXFORD. JNCI Cancer Spectrum (2019) 2(4): pky045. doi: 10.1093/jncics/pky045
Було проведене перехресне дослідження для оцінки розподілу типів ВПЛ і тягаря випадків онкологічних захворювань, пов’язаних із типами ВПЛ, що включені у вакцину 9вВПЛ, з метою оцінки потенційного впливу вакцин проти ВПЛ на зниження тягаря захворювань, пов’язаних з ВПЛ, та сприяння формулюванню рекомендацій із запобігання інфекції ВПЛ. При цьому використовувалися дані, отримані у масштабному міжнародному дослідженні, яке надало інформацію про вміст ДНК, мРНК і p16INK4a ВПЛ з фіксованої у формаліні та збереженої у парафінових блоках тканини з вогнищ ураження в аногенітальних ділянках та в ділянках голови і шиї з архівів патологічних матеріалів лікарень у 50 країнах. Досліджувані зразки включили 11 228 випадків раку шийки матки, 496 випадків раку анального каналу, 408 випадків раку піхви, 1709 випадків раку вульви. Відносний внесок ВПЛ у розвиток цих захворювань оцінювався за комбінованим показником позитивності на ДНК ВПЛ і позитивності на ДНК ВПЛ + (E6*I мРНК або p16INK4a).3
Середня кількість випадків онкологічних захворювань на рік у ділянках, в яких часто виявляється ВПЛ (ВПЛ-асоційовані онкологічні захворювання)2
Рак шийки матки
11 869

91% випадків, ймовірно, були обумовлені яким-небудь типом ВПЛa
Рак вульви
4 238

69% випадків, ймовірно, були обумовлені яким-небудь типом ВПЛa
Рак піхви
875

75% випадків, ймовірно, були обумовлені яким-небудь типом ВПЛa
Рак анального каналуb

Жінки
5150
93% випадків, ймовірно, були обумовлені яким-небудь типом ВПЛa
Чоловіки
2410
89% випадків, ймовірно, були обумовлені яким-небудь типом ВПЛa
a Типи ВПЛ, виявлені у дослідженні з генотипування; більшість були типами ВПЛ високого ризику, для яких відома їхня роль у розвитку онкологічних захворювань
b Включає плоскоклітинні карциноми анального каналу і прямої кишки.
Адаптовано за матеріалами Центрів з контролю і профілактики захворювань США (CDC). «ВПЛ і онкологічні захворювання. Як багато онкологічних захворювань пов’язані з ВПЛ щороку?»
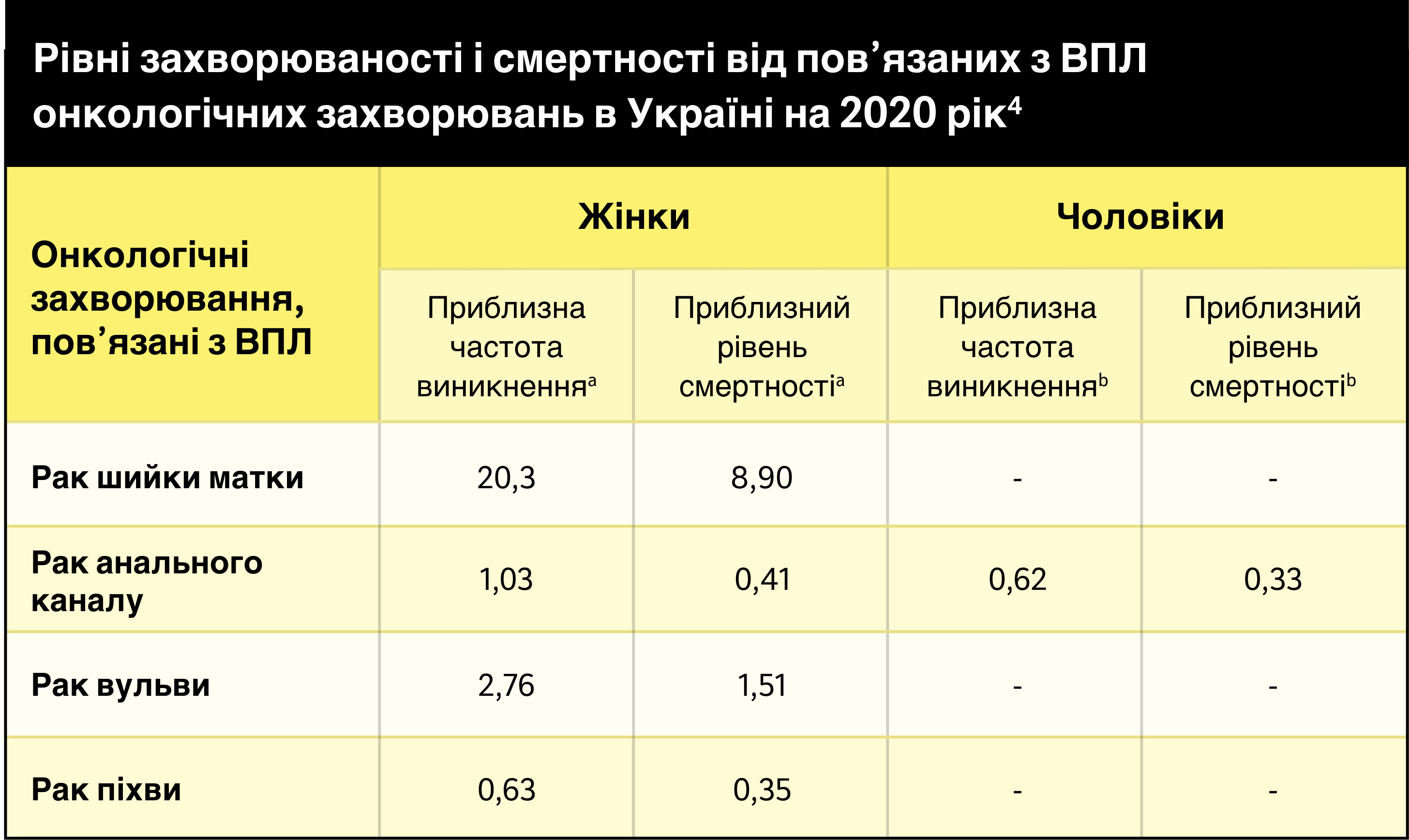
a Рівні на 100 000 жінок на рік
b Рівні на 100 000 чоловіків на рік
Адаптовано за матеріалами Bruni L, Albero G, Serrano B, Mena M, Collado JJ, Gómez D, Muñoz J, Bosch FX, de Sanjosé S. ICO/IARC Information Centre on HPV and Cancer(HPV Information Centre). Human Papillomavirus and Related Diseases in Ukraine. Summary Report 10 March 2023.
Accessed March 10, 2025.4
Зростання частоти виникнення випадків вульвовагінального раку в усьому світі5
Зростання частоти виникнення випадків раку вульви і піхви в останні два десятиріччя частково пояснюється збільшенням поширеності інфекції ВПЛ за епідеміологічними даними.5
Нові випадки вульвовагінального раку за оцінками в 2020 році4

РАК ВУЛЬВИ
45 240 нових випадків


РАК ПІХВИ
17 908 нових випадків
ВПЛ типів 16 і 18 присутні в6
ВИПАДКІВ РАКУ
ПІХВИ

ВИПАДКІВ
РАКУ
ВУЛЬВИ
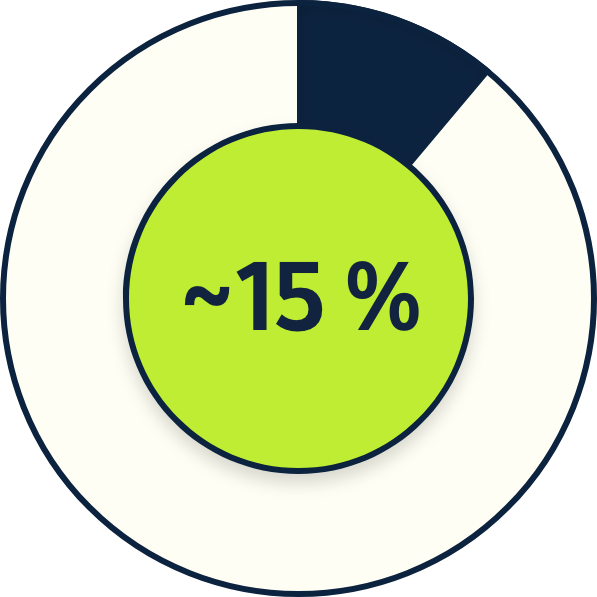
ВПЛ типів 31, 33, 45, 52 і 58 присутні в6
ВИПАДКІВ РАКУ
ПІХВИ

ВИПАДКІВ РАКУ
ВУЛЬВИ

Адаптовано за матеріалами Уряду Канади. Вакцини проти вірусу папіломи людини (ВПЛ): Канадська настанова з імунізації.
Програми щеплення проти ВПЛ представляють стратегію визначення пріоритетів боротьби зі зростаючою кількістю випадків вульвовагінального раку, оскільки доказові дані показують, що профілактичне щеплення проти ВПЛ, як у випадку передракових станів шийки матки, також запобігає виникненню пов’язаних з ВПЛ передракових станів вульви і піхви і має потенціал значущо знизити тягар пов’язаних з ВПЛ захворювань.5
Умовні скорочення:
CIN1 = цервікальна інтраепітеліальна неоплазія ступеня 1
CIN2 = цервікальна інтраепітеліальна неоплазія ступеня 2
CIN3 = цервікальна інтраепітеліальна неоплазія ступеня 3
ДНК = дезоксирибонуклеїнова кислота
ВПЛ = вірус папіломи людини
мРНК = матрична рибонуклеїнова кислота
p16INK4a = інгібітор циклін-залежної кінази 2A
СПИСОК ЛІТЕРАТУРИ
- Centers for Disease Control and Prevention. Epidemiology and Prevention of Vaccine-Preventable Diseases. The Pink Book. Chapter 11: Human Papillomavirus. https://www.cdc.gov/vaccines/pubs/pinkbook/hpv.html#print Accessed March 10, 2025.
- Centers for Disease Control and Prevention. HPV and Cancer. How Many Cancers Are Linked with HPV Each Year? https://www.cdc.gov/cancer/hpv/statistics/cases.htm Accessed March 10, 2025.
- de Sanjosé S., et al. Burden of Human Pappilomavirus (HPV)-Related Cancers Attributable to HPVs 6/11/16/18/31/33/45/52 and 58. OXFORD. JNCI Cancer Spectrum (2019) 2(4): pky045. doi: 10.1093/jncics/pky045
- Bruni L, Albero G, Serrano B, Mena M, Collado JJ, Gómez D, Muñoz J, Bosch FX, de Sanjosé S. ICO/IARC Information Centre on HPV and Cancer(HPV Information Centre). Human Papillomavirus and Related Diseases in Ukraine. Summary Report 10 March 2023. Accessed March 10, 2025.
- Bechini A, Moscadelli A, Velpini B, et al. Efficacy of HPV Vaccination Regarding Vulvar and Vaginal Recurrences in Previously Treated Women: The Need for Further Evidence. Vaccines (Basel). 2023;11(6):1084.
- Government of Canada. Human papillomavirus (HPV) vaccines: Canadian Immunization Guide. https://www.canada.ca/en/public-health/services/publications/healthy-living/canadian-immunization-guide-part-4-active-vaccines.html Accessed March 10, 2025.
Додаткова інформація по темі

Ключова інформація з безпеки
Гардасил® 9 являє собою ад’ювантну неінфекційну рекомбінантну 9-валентну вакцину, виготовлену з високоочищених вірусоподібних часток (ВПЧ) основного капсидного білка L1 9 типів ВПЛ (6, 11, 16, 18,31, 33, 45, 52, 58).
Показання
Вакцина Гардасил® 9 показана для активної імунізації осіб віком від 9 років для попередження наступних захворювань, спричинених ВПЛ*:
- Передракові стани та рак шийки матки, вульви, піхви та анального каналу, спричинені типами ВПЛ, які входять до складу вакцини.
- Генітальні кондиломи (Condyloma acuminata), спричинені певними типами ВПЛ.
Вакцина застосовується лише з профілактичною метою і не впливає на активні ВПЛ- інфекції або встановлене клінічне захворювання.
Протипоказання
Гіперчутливість до діючих речовин або до будь-якої з допоміжних речовин. Особи з гіперчутливістю після попереднього застосування вакцини Гардасил® 9 або Гардасил не повинні отримувати Гардасил® 9.
Спосіб Застосування Та Дози
Вакцину слід вводити шляхом внутрішньом’язової ін’єкції, бажано у дельтовидний м’яз плеча або передньолатеральну ділянку верхньої частини стегна. Вакцину не можна вводити внутрішньосудинно, підшкірно або внутрішньошкірно та не слід змішувати в одному шприці з будь-якими іншими вакцинами та розчинами.
Дозування
Для осіб віком від 9 до 14 років включно на момент першої ін’єкції можна застосовувати за схемою із двох доз (0, 6–12 місяців). Другу дозу слід вводити у період від 5 до 13 місяців після першої дози. Якщо другу дозу вакцини вводять раніше, ніж через 5 місяців після першої дози, то завжди слід ввести третю дозу. Гардасил® 9 можна застосовувати за трьохдозовою схемою (0, 2, 6 місяців). Другу дозу слід вводити не раніше, ніж через один місяць після першої дози, а третю дозу – не раніше, ніж через 3 місяці після другої дози. Всі три дози слід ввести протягом 1 року.
Особи віком 15 років і старше на момент першої ін’єкції – Гардасил® 9 слід застосовувати за трьохдозовою схемою (0, 2, 6 місяців). Другу дозу слід вводити не раніше, ніж через один місяць після першої дози, а третю дозу – не раніше, ніж через 3 місяці після другої дози. Всі три дози слід ввести протягом 1 року.
Особам, які отримали першу дозу вакцини Гардасил® 9, рекомендовано завершити повний курс щеплення
вакциною Гардасил® 9 .Необхідність застосування бустерної дози не встановлена.
Найбільш Поширені Побічні Реакції
побічні реакції у місці ін’єкції та головний біль , які, зазвичай, були легкої або помірної інтенсивності. Частота побічних реакцій встановлена як: дуже часті (≥ 1/10): головний біль, біль у місці ін’єкції, набряк, еритема; часті (від ≥ 1/100 до < 1/10): запаморочення, свербіж, гематома у місці ін’єкції, нудота, підвищена температура, стомлюваність.
Особливі Заходи Безпеки Та Особливості Застосування
Якщо у пацієнта відзначається тяжке гостре фебрильне захворювання, то введення вакцини слід відкласти. Як і у разі застосування всіх ін’єкційних вакцин, слід забезпечити набір відповідних лікарських засобів та нагляд на випадок розвитку рідкісних анафілактичних реакцій після введення вакцини. Синкопе (непритомність), що іноді супроводжується падінням, може виникати після або навіть перед будь-якою вакцинацією, особливо у підлітків, як психогенна відповідь на ін’єкцію голкою та може супроводжуватися кількома неврологічними ознаками, наприклад тимчасовим порушенням зору, парестезією та тоніко-клонічними рухами кінцівок в період відновлення стану. Тому за вакцинованими особами слід спостерігати протягом приблизно 15 хвилин після вакцинації Гардасил® 9 слід застосувати якомога швидше після вилучення з холодильника.
Перед застосуванням необхідно добре збовтати попередньо наповнений шприц для отримання суспензії та візуально перевірити суспензію на наявність механічних часток та зміни кольору. Вакцину слід застосовувати в тому вигляді, в якому вона постачається. Слід використовувати рекомендоване дозування в повному об’ємі.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Безпека та імуногенність у осіб, які отримували імуноглобулін або препарати крові протягом 3 місяців до вакцинації, в клінічних дослідженнях не вивчалися.
Застосування з іншими вакцинами: Гардасил® 9 можна вводити одночасно з комбінованою бустерною вакциною проти дифтерії і правця з кашлюковим та/або поліомієлітним [інактивованим] (IPV) компонентом. Відсутні дані про безпеку, імуногенність та ефективність, які б підтверджували взаємозамінність вакцини Гардасил® 9 з бівалентними або квадривалентними вакцинами проти ВПЛ. Застосування з гормональними контрацептивами не впливало на типоспецифічну імунну відповідь при застосуванні вакцини Гардасил® 9.
За відсутності досліджень сумісності цей лікарський засіб не слід змішувати з іншими лікарськими засобами.
Інформація Щодо Застосування Особливими Групами Населення
Діти віком ˂ 9 років: безпека та ефективність застосування вакцини Гардасил® 9 дітям віком до 9 років не встановлені. Дані відсутні.
Вагітність: недостатньо даних для того, щоб рекомендувати застосування вакцини Гардасил® 9 у період вагітності. Слід відкласти вакцинацію до завершення вагітності. Лактація: Гардасил® 9 можна застосовувати у період годування груддю.
У осіб з порушенням імунологічної реактивності внаслідок застосування потужної імуносупресивної терапії, генетичного дефекту, інфікування вірусом імунодефіциту людини (ВІЛ) чи з інших причин, реакція на вакцину може бути відсутньою. Вакцину слід з обережністю вводити пацієнтам з тромбоцитопенією або будь-якими порушеннями згортання крові через ризик розвитку кровотечі після внутрішньом’язового введення у таких пацієнтів.
Як і будь-яка інша вакцина, вакцинація вакциною Гардасил® 9 забезпечує захист не у всіх вакцинованих. Вакцина забезпечує захист лише проти захворювань, викликаних типами ВПЛ, на які спрямована вакцина.Очікується, що Гардасил® 9 забезпечує захист проти типів ВПЛ, які спричиняють приблизно: 90 % випадків раку шийки матки; більш ніж 95 % випадків аденокарциноми in situ (AIS); 75–85 % випадків внутрішньоепітеліальної неоплазії шийки матки високого ступеня градації (CIN 2/3), 85–90 % випадків раку вульви, пов’язаного з ВПЛ; 90–95 % випадків внутрішньоепітеліальної неоплазії вульви високого ступеня градації, пов’язаної з ВПЛ (VIN 2/3); 80–85 % випадків раку піхви, пов’язаного з ВПЛ; 75–85 % випадків внутрішньоепітеліальної неоплазії піхви високого ступеня градації, пов’язаної з ВПЛ (VaIN 2/3); 90–95 % випадків анального раку, пов’язаного з ВПЛ; 85–90 % випадків внутрішньоепітеліальної неоплазії анального каналу високого ступеня градації, пов’язаної з ВПЛ (AIN 2/3), та 90 % випадків генітальних кондилом.
Для повідомлення про небажані явища при застосуванні лікарських засобів компанії МСД, зателефонуйте нам +38 044 393 74 80 або напишіть pharmacovigilance.ukraine&cis@merck.com.
Реєстраційне посвідчення № UA/20128/01/01.
UA-GSL-00002 | Матеріал дійсний до: 02.2027
