ВПЛ і тенденції вакцинації

Генітальні бородавки можуть бути передвісником підвищеного ризику розвитку раку, асоційованого з ВПЛ1
Інфекції, викликані ВПЛ з низьким ризиком, можуть призвести до появи генітальних бородавок. Відповідальними за появу приблизно 90 % таких бородавок є ВПЛ типів 6 і 112
Приблизно у
5 % – 10 %
людей протягом життя з’являлася хоча б одна генітальна бородавка2
Генітальні бородавки вважаються доброякісними, незважаючи на те, що їх важко лікувати і вони часто з’являються повторно.1
Дослідження показали, що пацієнти з генітальними бородавками належать до групи високого ризику появи раку, асоційованого з ВПЛ.1
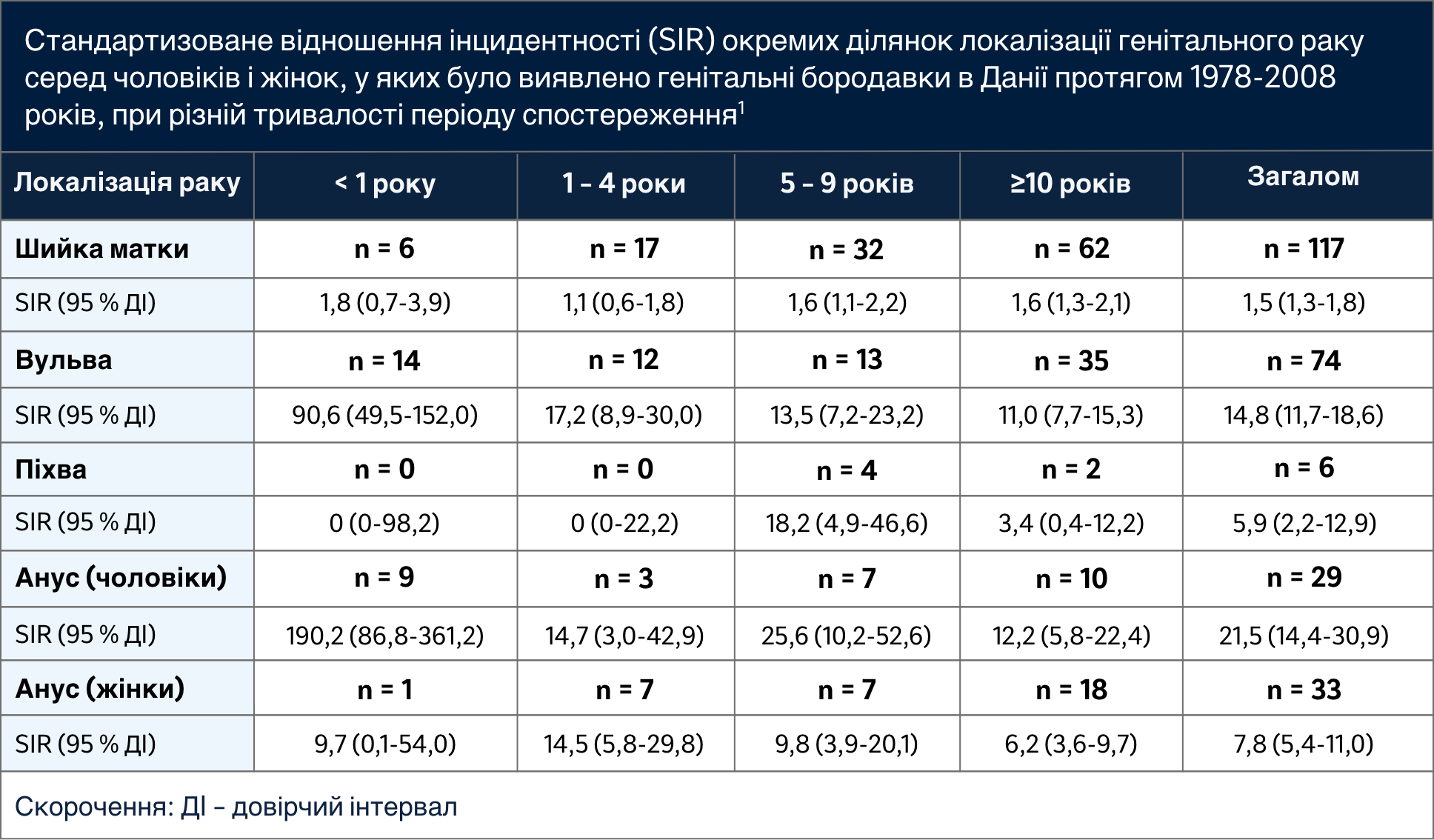
Адаптовано з таблиці 1, Bloomberg M et al. J Infect Dis. 2012; 205 (10): 1544-1553
Особливо у чоловіків показники SIR для раку, асоційованого з ВПЛ, збільшуються1:
- Зі збільшенням віку
- Зі збільшенням кількості років існування діагнозу кондилом
Сучасні теорії про те, чому люди з генітальними бородавками мають підвищений ризик появи раку у майбутньому1:

У генітальних бородавках часто виявляються типи ВПЛ з високим ризиком, які можуть призвести до раку

Імунологічні відмінності у пацієнтів з генітальними бородавками спричиняють вищий рівень персистенції інфекцій, викликаних ВПЛ, та підвищений ризик появи раку у майбутньому
Реалістичним способом ерадикації онкогенного вірусу папіломи людини є проведення гендерно- нейтральної вакцинації3
Після запровадження вакцинації проти ВПЛ для дівчат у багатьох країнах4,5 відмічається тенденція до зниження захворюваності та поширеності інфекцій та захворювань, пов’язаних з ВПЛ, проте серед чоловіків тягар захворювань, асоційованих з ВПЛ, залишається високим.6
Щоб посилити колективний імунітет, багато країн перейшли від вакцинації лише жінок до гендерно-нейтральної вакцинації.3
Колективний ефект між дівчатками та хлопчиками3
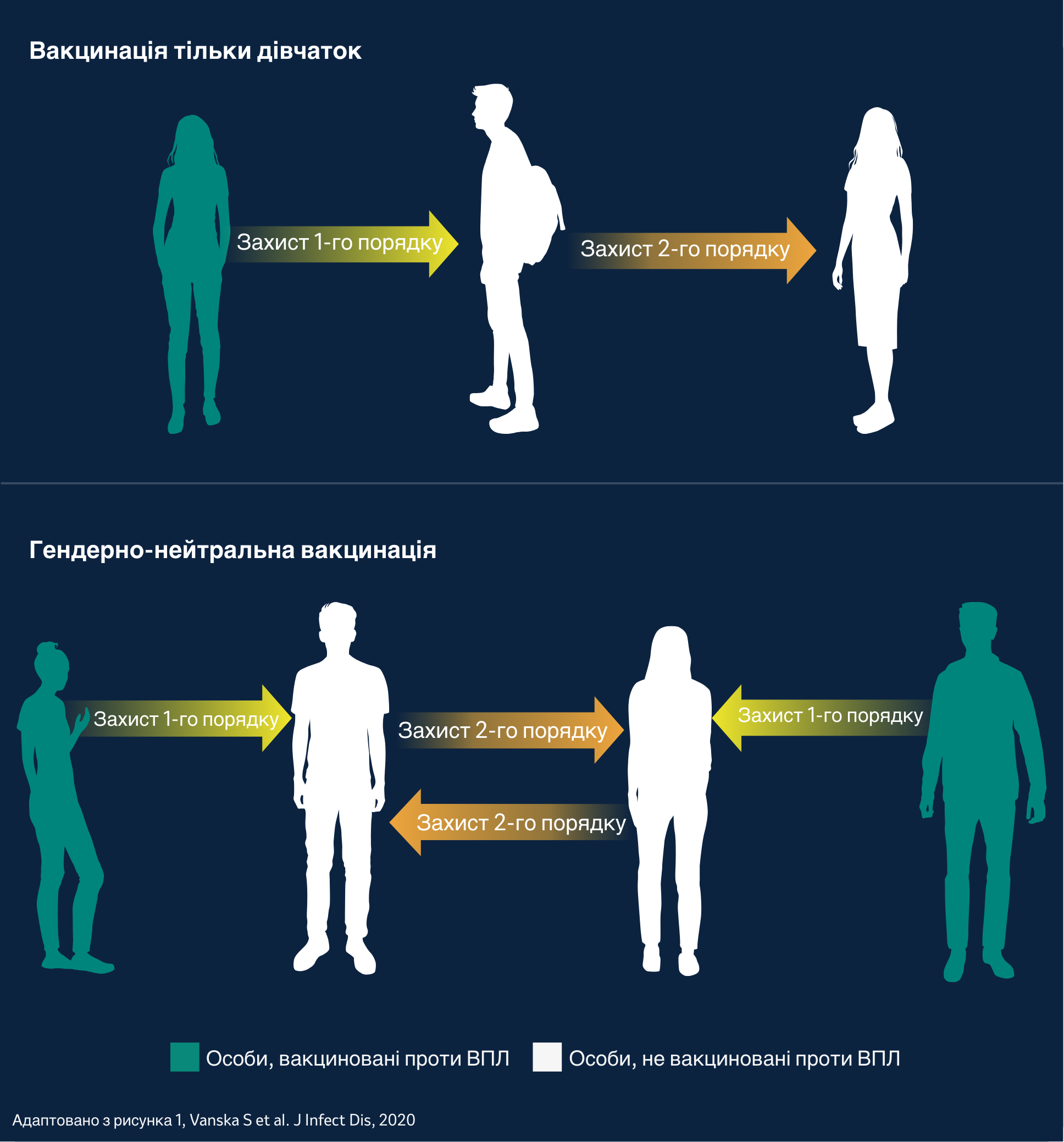
Колективний ефект, спричинений вакцинацією проти ВПЛ. На рисунку зображується колективний захист першого порядку від вакцинованих дівчат до невакцинованих хлопчиків (вакцинація лише дівчаток) і від вакцинованих дівчаток і хлопчиків до невакцинованих хлопчиків і дівчаток (гендерно нейтральна вакцинація), а також колективний захист другого порядку від невакцинованих осіб, але захищених колективним імунітетом.
У період з 2007 по 2014 рр. було проведено рандомізоване за громадою дослідження (CRT), щоб порівняти загальний вплив стратегії вакцинації лише для дівчат та стратегії гендерно-нейтральної вакцинації на зниження поширеності ВПЛ серед підлітків у Фінляндії, яким раніше не робили щеплення від ВПЛ. У цьому дослідженні 33 громади шляхом рандомізації розподілили у 3 групи – 11 громад у групі А з гендерно-нейтральною вакцинацією, 11 громад у групі В з вакцинацією лише дівчат та 11 громад у групі С, яка була контрольною групою. У групах A і B вводили вакцину проти ВПЛ; а хлопчикам та дівчаткам у контрольній групі C вводили вакцину проти вірусу гепатиту В. У дослідженні брали участь понад 35000 осіб, які перебували за межами агломерації Гельсінкі на відстані 35 км. Три дози вакцини (у місяці 0, 1 і 6) ввели 99,4% учасників у школах: для дівчаток та хлопчиків у групі А та дівчаток у групі В конкретна інформація про вакцинацію залишалася закритою до 18,5 років. У дослідженні визначали захисну ефективність, ефективність вакцини для вакцинованих дівчаток і колективний ефект для невакцинованих дівчаток в усій популяції дівчаток-підлітків.3
Усім мешканкам досліджуваних громад, які народилися в 1992–1995 роках, у тому числі тим, хто спочатку не брав участі у дослідженні, запропонували відвідати клініку у віці 18,5 років протягом 2010–2014 років. Зразки із шийно-вагінального відділу, зібрані для проведення тесту на наявність ВПЛ та C trachomatis для допоміжних досліджень, типували на ВПЛ 6, 11, 16, 18, 35, 39, 45, 51, 52, 56, 58, 59, 66 та 68 (наявність дезоксирибонуклеїнової кислоти [ДНК] ВПЛ, виявлена за допомогою полімеразної ланцюгової реакції (ПЛР)). Усі жінки-учасниці погодилися взяти участь у скринінговому дослідженні для виявлення C trachomatis і заповнили анкету, що стосується демографічної інформації, чинників способу життя та сексуального здоров’я. Нарешті, учасникам пропонували вакцину, яку вони не отримували на початку дослідження.3
Охоплення вакцинацією 90% дівчат або більше може призвести до викорінювання онкогенних типів ВПЛ у загальній популяції, але охоплення гендерно-нейтральною вакцинацією 75 % підлітків раннього віку може дозволити досягти такого самого захисту при вищій можливості реалізації.7
Порівняння ерадикації типів ВПЛ з високим ризиком залежно від ефективності охоплення вакцинацією при використанні стратегії вакцинації лише дівчат або стратегії гендерно-нейтральної вакцинації.7
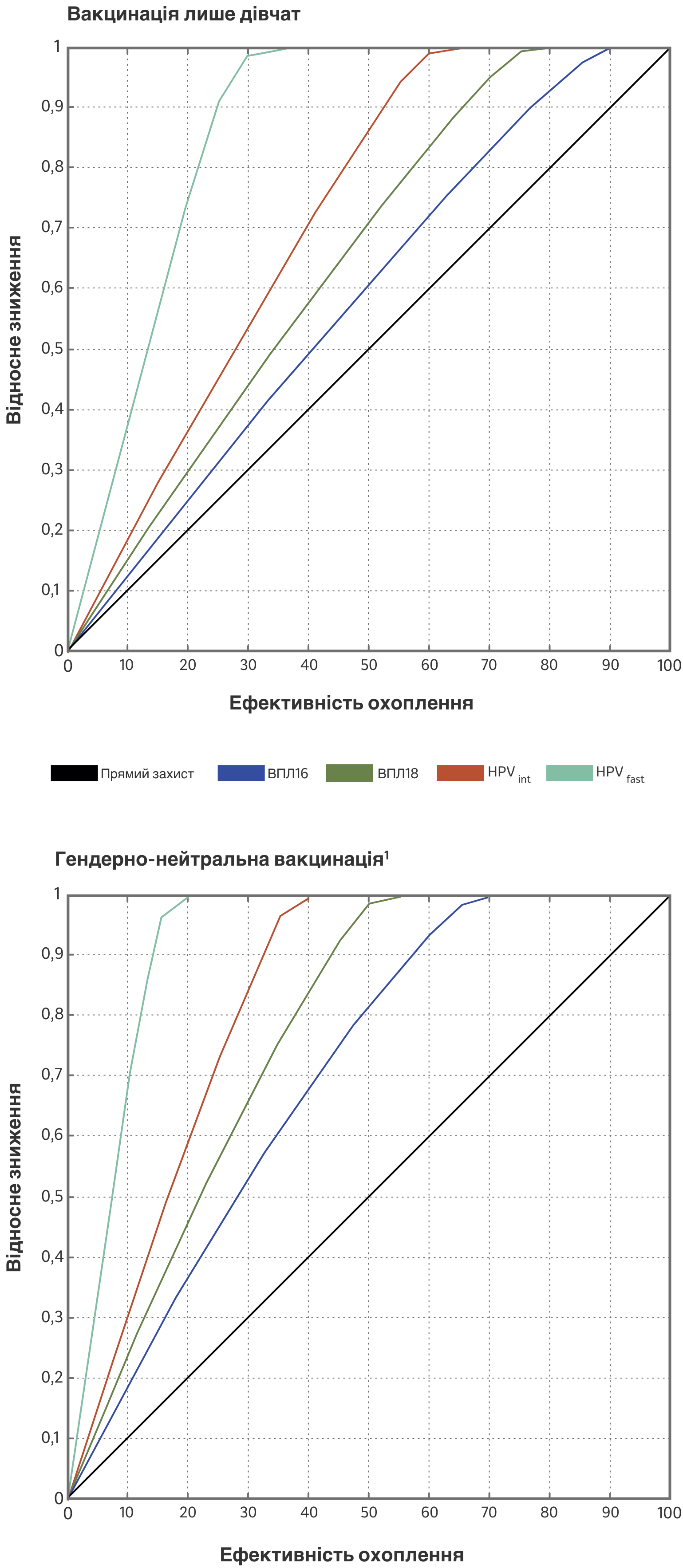
Адаптовано з рисунка 4, 4, Lehtinen M et al. Expert Review of Vaccines, 18:2, 153-160
Підхід з проведенням поздовжнього дослідження дозволив визначити, як переваги вакцинації проти ВПЛ, і зрештою захист від раку, переважують будь-які несприятливі ефекти вакцинації в серії популяційних досліджень, а також як досягається повний вплив колективного ефекту завдяки гендерно нейтральній вакцинації. Поздовжнє дослідження також дозволило виявити, що ВПЛ 16/18 супроводжується високим ризиком розвитку раку піхви, вульви, ротоглотки та анального раку. Вірусоподібні частинки (VLP) містять білки L1 вірусу папіломи, що самозбираються, і це забезпечує високу профілактичну ефективність вакцини у тварин і проти інфекцій, асоційованих з ВПЛ16, у людей.7
ВПЛ-інфекції можуть залишатися в організмі в стані спокою роками8
Іноді вірус ВПЛ може здатися відсутнім, але залишатися невиявленим в організмі у вигляді латентних інфекцій, які реактивуються лише під час пригнічення імунної системи або часто без будь-якої очевидної причини.9
Ризик інфікування типами ВПЛ з високим ризиком з віком значно знижується у молодих жінок віком від 20 до 29 років, тоді як у літніх жінок віком від 40 до 50 років спостерігалося лише незначне, недостовірне зниження.8
Залежна від віку поширеність інфекції, викликаної ВПЛ 168
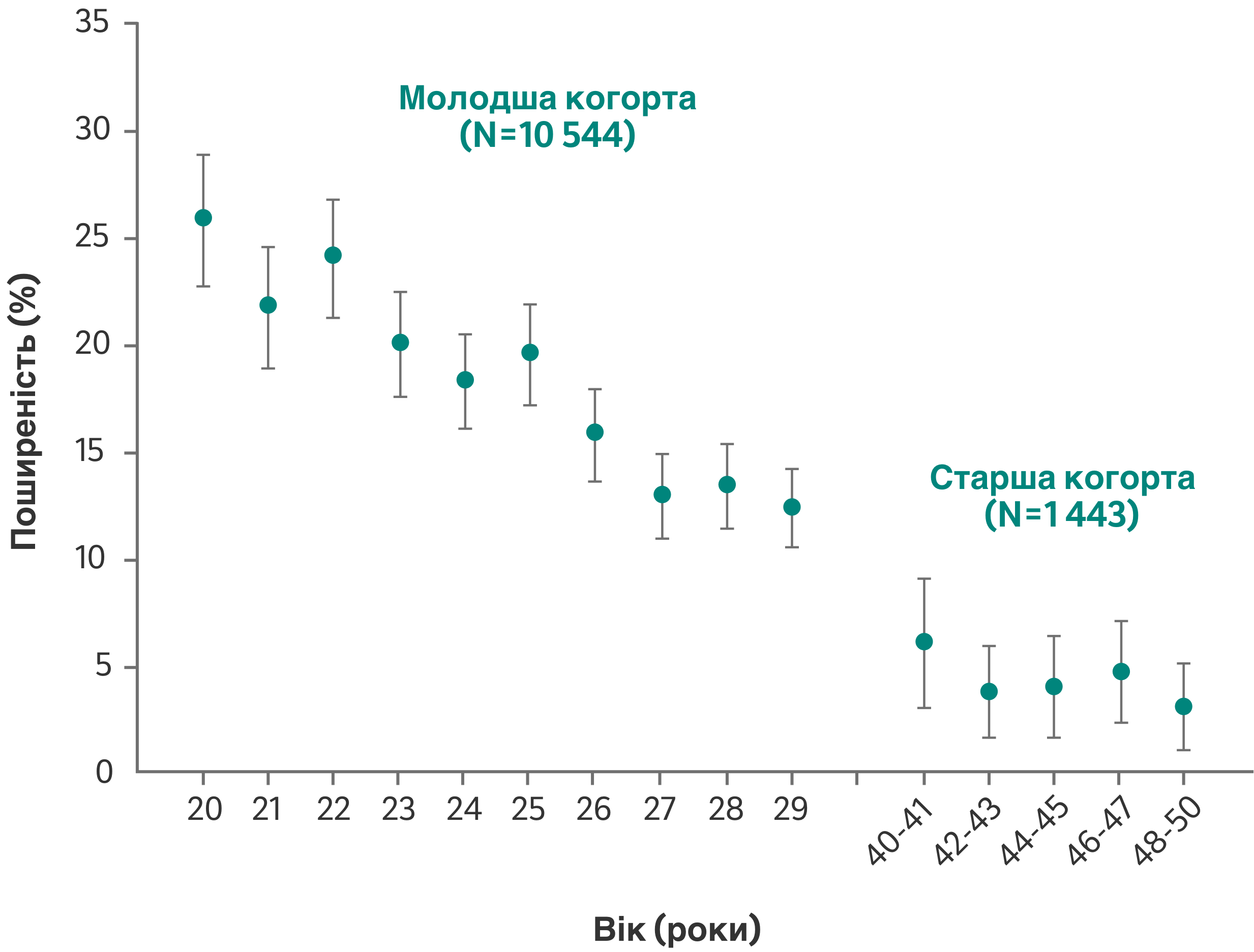
Адаптовано з рисунка 1, Nelsen A et al. Sexually transmitted diseases. 2008; 35 (3): 276-282
Припускають, що інфекції, спричинені типами ВПЛ з високим ризиком, у жінок старшого віку здебільшого виникають завдяки активації персистуючої інфекції, в той же час недавні сексуальні партнери мають менше значення.8
У перехресному популяційному когортному дослідженні оцінювали тягар ВПЛ-інфекції разом із профілем чинників ризику для поширеності інфекцій, викликаних типами ВПЛ з високим ризиком, та інфекцій, викликаних одразу декількома типами ВПЛ з високим ризиком. Загальна популяція була поділена на 2 когорти жінок віком 20-29 років (n=10544) та 40-50 років (n=1443). Усі учасниці підписали письмові форми інформованої згоди та були випадковим чином відібрані серед загального населення Копенгагена, Данія. Спеціально навчені жінки-медсестри провели з учасницями особисту бесіду. Опитування включало запитання про соціально-демографічні показники, використання контрацептивів, сексуальну поведінку, попередні захворювання, що передаються статевим шляхом, репродуктивний анамнез, проведення скринінгу шийки матки у минулому та про звичку куріння. Крім того, було проведено гінекологічне обстеження, а за допомогою спеціальних ватних тампонів було взято зразки із шийки матки та мазки Папаніколау, які зберігалися в пробірках для ВПЛ до проведення аналізу та генотипування за допомогою гібридного захоплення та аналізу LiPA.8
Онкогенний потенціал ВПЛ підвищує бар’єри для вагітності та пологів9

Невакциновані люди залишаються вразливими до раку та передракових захворювань, викликаних ВПЛ, що може вимагати проведення лікування, яке знижує фертильність, наприклад, гістеректомія, хіміотерапія та променева терапія.10
Лікування передраку шийки матки, спричиненого ВПЛ, також може піддавати жінок ризику виникнення порушень у шийці матки, що іноді може спричинювати передчасні пологи.10
Незалежно від ризиків, пов’язаних із раком, ВПЛ може прямо чи опосередковано підвищувати ризик безпліддя, спонтанних абортів, передчасних пологів, прееклампсії та інших ускладнень.10
Скорочення:
ВПЛ = вірус папіломи людини
LiPA = лінійний імуноаналіз за допомогою зонда INNO
СПИСОК ЛІТЕРАТУРИ
- Bloomberg M, Friis S, Munk C, et al. Genital Warts and Risk of Cancer: A Danish Study of Nearly 50000 Patients With Genital Warts. The Journal of Infectious Diseases. 2012;205:1544–53.
- Dominiak-Felden G, Gobbo C, Simondon F. Evaluating the Early Benefit of Quadrivalent HPV Vaccine on Genital Warts in Belgium: A Cohort Study. 2015. PLoS ONE 10(7): e0132404. doi:10.1371/ journal.pone.0132404
- Vänskä, S, Luostarinen T, Baussano I, et al. Vaccination With Moderate Coverage Eradicates Oncogenic Human Papillomaviruses If a Gender-Neutral Strategy Is Applied. The Journal of Infectious Diseases. 2020;222:948–56.
- Brisson M, Benard E, Drolet M, et al. Population-level impact, herd immunity, and elimination after human papillomavirus vaccination: a systematic review and meta-analysis of predictions from transmission-dynamic models. Lancet Public Health. 2016;1(1):e8-e17.
- Drolet M, Benard E, Perez N, et al. Population-level impact and herd effects following the introduction of human papillomavirus vaccination programmes: updated systematic review and ,meta analysis. Lancet. 2019;394(10197):497-509.
- Giuliano AR, Lazcano-ponce E, Luisa L, et al. The human papillomavirus infection in men study: Human papillomavirus prevelance and type distribution among men residing in Brazil, Mexico, and the United States. Cancer Epidemiol Biomarkers Prev. 2008; 17(8):2036-2043.
- Lehtinen, M, Baussano I, Paavonen J, et al. Eradication of human papillomavirus and elimination of HPV-related diseases– scientific basis for global public health policies, Expert Review of Vaccines, 18:2, 153-160, DOI: 10.1080/14760584.2019.1568876
- Nielsen A, Kjaer SK, Munk C, Ifner, T. Type-Specific HPV Infection and Multiple HPV Types: Prevalence and Risk Factor Profile in Nearly 12,000 Younger and Older Danish Women. Sexually Transmitted Diseases, March 2008, Vol. 35, No. 3, p.276–282.
- Alizon S, Murall CL, Bravo IG. Why human papillomavirus acute infections matter. Viruses 2017, 9, 293; doi:10.3390/v9100293
- CDC Fact Sheet. HPV Vaccine is Cancer Prevention. 2021. https://www.cdc.gov/vaccines/partners/downloads/teens/vaccinesafety. pdf. Accessed October 2, 2023.
UA-HPV-00106 | Матеріал затверджений: 10.2023 | Матеріал дійсний до: 08.2025

Широкий моніторинг безпечності підтверджує профіль безпеки вакцинації проти ВПЛ1
За останні 20 років в усьому світі було досягнуто багато успіхів в оцінці та впровадженні вакцин проти вірусу папіломи людини (ВПЛ) на основі вірусоподібних частинок (VLP)2.


Адаптовано зі статті Vichnin M, et al; The Pediatric infectious disease journal. 2015 Sep 1;34(9):983-91.
Оцінка безпеки та побічних явищ включала3:

Досвід вивчення безпеки у клінічних дослідженнях включає людей з ВІЛ-інфекцією та аутоімунними захворюваннями.4
У короткому викладі опублікованих після реєстрації даних про безпеку на підставі результатів активного та пасивного моніторингу, проведеного для 4-валентної вакцини проти ВПЛ, комплексна глобальна програма нагляду за безпекою є однією з найбільших постмаркетингових баз даних про безпеку для будь-якої вакцини та може служити моделлю для оцінки інших нових вакцин.4
Під час 5 клінічних досліджень ІІІ фази, в яких брали участь 21480 дівчат віком 9-26 років і хлопців віком 9-16 років, вакцинація загалом добре переносилася, і реципієнти вакцини та плацебо повідомляли про подібну частоту системних побічних явищ, серйозних побічних явищ та нових патологічних станів, які потенційно узгоджуються з аутоімунними явищами. Подібні результати були отримані під час клінічних досліджень за участю 3819 жінок віком від 24 до 45 років і 4065 чоловіків віком від 16 до 26 років. Ці дослідження включають дослідження як з пасивним, так і з активним спостереженням.4

У клінічних дослідженнях для ГАРДАСИЛУ® найчастішими побічними явищами (≥5 %) були реакції у місці ін’єкції, головний біль та гарячка. Більшість побічних явищ мали легкий або помірний ступінь інтенсивності. Ці дані включають як 2-дозову, так і 3-дозову схему вакцинації.6
Докази підтверджують сприятливий профіль співвідношення ризику та користі для вакцин проти ВПЛ7
З моменту реєстрації вакцин проти ВПЛ міжнародні органи охорони здоров’я дійшли висновку, що переваги вакцинації проти ВПЛ переважують потенційні ризики.7
Побічні явища, про які повідомлялося після отримання ліцензії, відповідають тим, які було ідентифіковано під час клінічних досліджень.8
Під час спостереження за появою аутоімунних захворювань, включаючи комплексний регіональний больовий синдром, синдром постуральної ортостатичної тахікардії, системний червоний вовчак, ревматоїдний артрит, синдром Гієна-Барре та розсіяний склероз, не було виявлено проблем, пов’язаних з безпекою.1,9

Забезпечте своїм пацієнтам повний захист, на який вони заслуговують
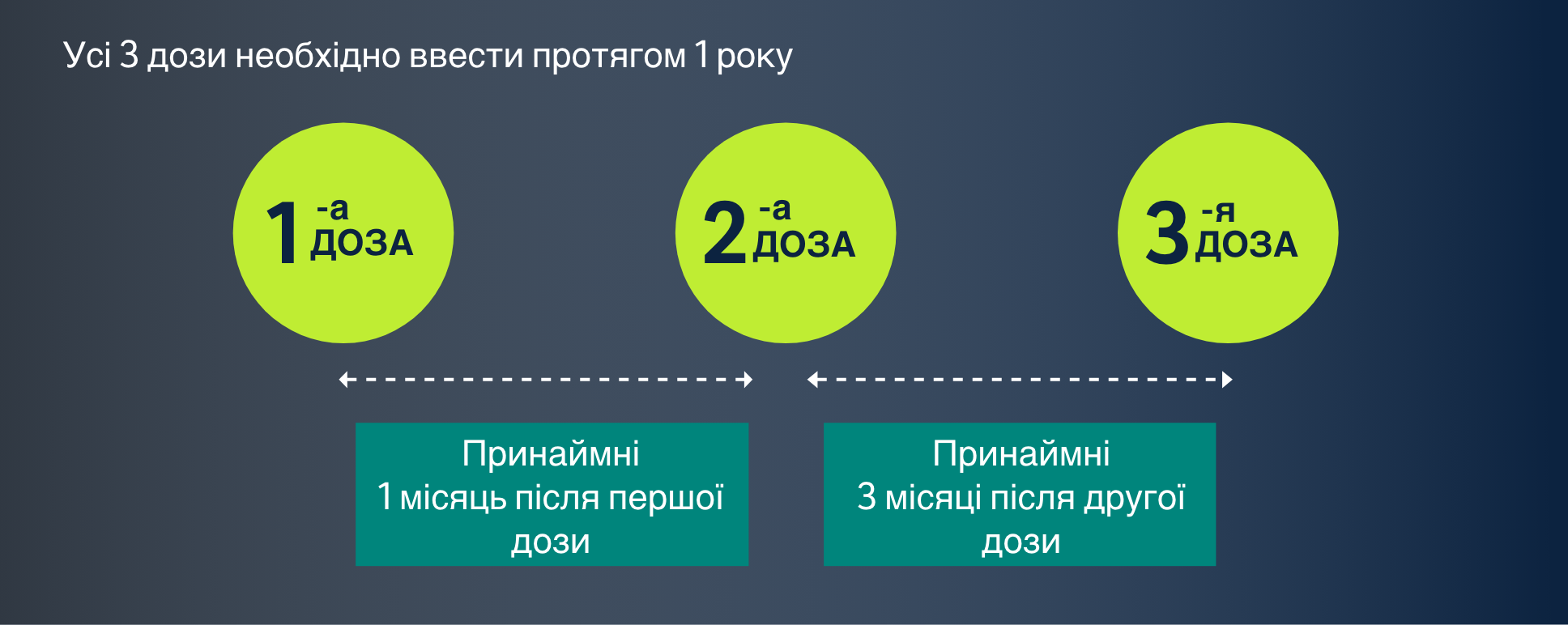
Рекомендована повна схема дозування включає 3-дозову схему для дорослих і 2-дозову схему для осіб віком 9-13 років.12
Рекомендована схема введення12
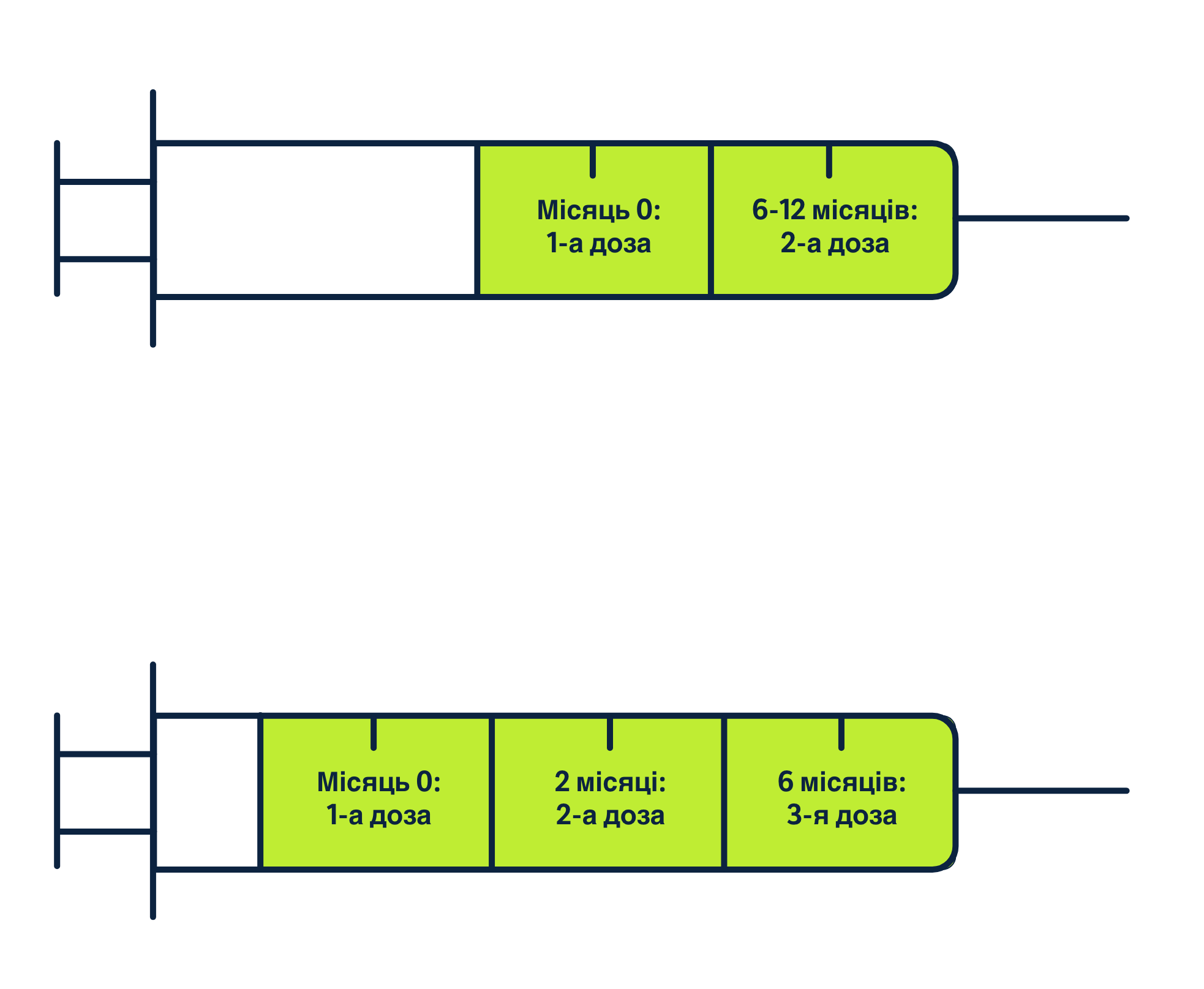
Інтервали між введенням ГАРДАСИЛУ® 12
Якщо особі віком 9-13 років другу дозу вакцини ввели раніше ніж через 6 місяців після першої дози, то завжди потрібно вводити третю дозу.12
Затримка або пропущена вакцинація може чинити короткостроковий і довгостроковий вплив на захворювання, пов’язані з ВПЛ.13
Модельована оцінка впливу пропущеної вакцинації проти ВПЛ через пандемію COVID-19 на випадки певних типів раку та захворювань, пов’язаних з ВПЛ, протягом 100 років у Сполучених Штатах Америки:
CIN1
22 503 – 48 157 випадків
Рак шийки матки
2 882 – 6 487 випадків
Генітальні бородавки
130 853 – 213 926 випадків
CIN2
48 682 – 110 192 випадків
Вакцини проти ВПЛ також забезпечують перехресний захист від інших підтипів вірусу, яких немає у складі вакцини, оскільки родина вірусу ВПЛ має багато спільних білків.14

Скорочення:
AEs = побічні явища
CDC = Центри контролю та профілактики захворювань
CIN = цервікальна інтраепітеліальна неоплазія
CIN2+ = цервікальна інтраепітеліальна неоплазія 2-го ступеня або вище
CIN3+ = цервікальна інтраепітеліальна неоплазія 3-го ступеня або вище
CRPS = комплексний регіональний больовий синдром
EMA = Європейське агентство з оцінки лікарських засобів
FDA = Управління з контролю за якістю харчових продуктів та медикаментів
ВПЛ = вірус папіломи людини
POTS = синдром постуральної ортостатичної тахікардії
ВООЗ = Всесвітня організація охорони здоров’я
СПИСОК ЛІТЕРАТУРИ
- World Health Organization. Wkly Epidemiol Rec. 2017;92 (28):393–404.
- Giuliano AR, Stanley MA. Current and future vaccine clinical research with the licensed 2-, 4-, and 9-valent VLP HPV vaccines: What’s ongoing, what’s needed?. Preventive medicine. 2021 Mar 1;144:106321.
- Gee J, Weinbaum C, Sukumaran L, et al. Quadrivalent HPV vaccine safety review and safety monitoring plans for nine-valent HPV vaccine in the United States. Human vaccines & immunotherapeutics. 2016 Jun 2;12(6):1406-17.
- Vichnin M, Bonanni P, Klein NP, et al. An overview of quadrivalent human papillomavirus vaccine safety: 2006 to 2015. The Pediatric infectious disease journal. 2015 Sep 1;34(9):983-91.
- Kjaer SK, Nygård M, Sundström K, et al. Final analysis of a 14-year long-term follow-up study of the effectiveness and immunogenicity of the quadrivalent human papillomavirus vaccine in women from four nordic countries. EClinicalMedicine. 2020 Jun 1;23.
- Macartney KK, Chiu C, Georgousakis M et al. Safety of human papillomavirus vaccines: a review. Drug safety. 2013 Jun;36:393-412.
- European Medicines Agency (EMA). Human papillomavirus vaccines – Cervarix, Gardasil, Gardasil 9, Silgard. https:// www.ema.europa.eu/en/medicines/human/referrals/human-papillomavirus-vaccines-cervarix-gardasil-gardasil-9-silgard. Accessed October 2, 2023.
- Centers for Disease Control and Prevention (CDC). Meites E et al. Human papillomavirus. In: Hall E et al, eds. Epidemiology and Prevention of Vaccine-Preventable Diseases. 14th ed. Public Health Foundation; 2021.
- Grimaldi-Bensouda L, Guillemot D, Godeau B, et al. Autoimmune disorders and quadrivalent human papillomavirus vaccination of young female subjects. J Intern Med. 2014;275(4):398-408.
- European Medicines Agency (EMA). Gardasil: procedural steps taken and scientific information after the authorization. https:// www.ema.europa.eu/en/documents/procedural-steps-after/gardasil-epar-procedural-steps-taken-scientific-information after-authorisation_en.pdf. Accessed October 2, 2023.
- Markowitz LE, Julianne G, Chesson H, et al. Ten years of human papillomavirus vaccination in the united states. Acad Pediatr. 2018;18(2S):S3–S10. 27.2018
- Інструкція для медичного застосування лікарського засобу Гардасил / GARDASIL®
- Daniels V. et al. Impact of reduced human papillomavirus vaccination coverage rates due to COVID-19 in the United States: A model based analysis. Vaccine. 2021; 39(20):2731-2735.
- Braaten KP, Laufer MR. Human Papillomavirus (HPV), HPV-Related Disease, and the HPV Vaccine. 2008;(1):2-10.
UA-HPV-00107 | Матеріал затверджений: 10.2023 | Матеріал дійсний до: 08.2025

