Вакцинація ГАРДАСИЛ®
Дізнайтеся як ГАРДАСИЛ® забезпечує захист від ВПЛ
ГАРДАСИЛ® з високою частотою забезпечував* захист від 4 типів ВПЛ, попереджаючи розвиток захворювань, пов’язаних з ВПЛ.1
*Ефективність ГАРДАСИЛУ® оцінювали в 4 плацебо-контрольованих, подвійних сліпих, рандомізованих клінічних дослідженнях II та III фази, в яких брали участь 20 541 жінка, яку включали у дослідження та вакцинували без проведення попереднього скринінгу на наявність ВПЛ-інфекції.
Основні кінцеві параметри ефективності включали частоту пов’язаних з ВПЛ 6-, 11-, 16- або 18 уражень вульви та піхви (генітальні кондиломи, інтраепітеліальна неоплазія вульви та інтраепітеліальна неоплазія піхви) і частоту цервікальної інтраепітеліальної неоплазії (CIN) будь-якого ступеня та частоту раку шийки матки (протокол 013, дослідження FUTURE I), частоту пов’язаних з ВПЛ 16 або ВПЛ 18 випадків CIN 2/3-го ступеня та частоту аденокарциноми in situ та раку шийки матки (протокол 015, дослідження FUTURE II), частоту персистуючих інфекцій та захворювань, пов’язаних з ВПЛ 6, 11, 16 або 18 (протокол 007), а також частоту пов’язаної з ВПЛ 16 персистуючої інфекції (протокол 005).

ВПЛ 6 і 11 спричинюють приблизно 90% випадків генітальних кондилом і 10 % випадків інтраепітеліальної неоплазії шийки матки низького ступеня (CIN 1).
За оцінками, ВПЛ 16 і ВПЛ 18 є відповідальними за розвиток приблизно 70 % випадків раку шийки матки та 75-80% випадків анального раку; 80% випадків аденокарциноми in situ (AIS); 45-70 % випадків інтраепітеліальної неоплазії шийки матки високого ступеня (CIN 2/3); 25% випадків інтраепітеліальної неоплазії шийки матки низького ступеня (CIN 1); приблизно 70% пов’язаних з ВПЛ випадків інтраепітеліальної неоплазії вульви високого ступеня (VIN 2/3) та інтраепітеліальної неоплазії піхви високого ступеня (VaIN 2/3), а також 80% випадків пов’язаної з ВПЛ анальної інтраепітеліальної неоплазії високого ступеня (AIN 2/3).
Загальна ефективність ГАРДАСИЛУ® проти ВПЛ, що викликає рак та інші захворювання
Дослідження показали, що ГАРДАСИЛ® з високою частотою попереджав розвиток ВПЛ-інфекції, з якою пов’язані деякі типи раку та інші захворювання.1
Ефективність у жінок віком від 16-45 років
100 %
(95 % ДІ: 62.8, 100.0; 0 проти 12 випадків [n = 2572 із об’єднаних досліджень у молодих жінок])
Ефективність щодо попередження захворювань, викликаних рецидивом того ж типу ВПЛ (6, або 11, або 16, чи 18 типу) відносно цервікальної інтраепітеліальної неоплазії (CIN2/3), інтраепітеліальної неоплазії вульви високого ступеня (VIN 2/3), інтраепітеліальної неоплазії піхви високого ступеня (VaIN 2/3) і генітальних кондилом у дівчат та жінок віком 16-26 років.a,1
68.2%
(95 % ДІ: 17.9, 89.5; 6 проти 20 випадків [n= 832 із комбінованих досліджень у молодих і дорослих жінок])
Ефективність відносно персистуючої інфекції, викликаної ВПЛ 16 і 18, у дівчат та жінок віком 16-45 років.a,1
84.7%
(95 % ДІ: 67.5, 93.7)
Ефективність відносно частоти комбінованої персистуючої інфекції, генитальних кондилом, уражень вульви та піхви, CIN будь-якого ступеня, аденокарциноми in situ та раку шийки матки, пов’язаних з ВПЛ 16 або 18 типів.
88.7%
(95 % ДІ: 78.1, 94.8)
Ефективність відносно частоти комбінованої персистуючої інфекції, генитальних кондилом, уражень вульви та піхви, CIN будь-якого ступеня, аденокарциноми in situ та раку шийки матки, пов’язаних з ВПЛ 6, 11, 16 або 18 типів.
Дослідження FUTURE I та II: ефективність Гардасилу® оцінювали у жінок віком від 16 до 26 років в 4 плацебо-контрольованих, подвійних сліпих, рандомізованих клінічних дослідженнях II та III фази, в яких брали участь 20 541 жінка, яку включали у дослідження та вакцинували без проведення попереднього скринінгу на наявність ВПЛ-інфекції. Основні кінцеві параметри ефективності включали частоту пов’язаних з ВПЛ 6, 11, 16 або 18 уражень вульви та піхви (генітальні бородавки, інтраепітеліальна неоплазія вульви та інтраепітеліальна неоплазія піхви) і частоту цервікальної інтраепітеліальної неоплазії (CIN) будь-якого ступеня та частоту раку шийки матки (протокол 013, дослідження FUTURE I), частоту пов’язаних з ВПЛ 16 або ВПЛ 18 випадків CIN 2/3-го ступеня та частоту аденокарциноми in situ та раку шийки матки (протокол 015, дослідження FUTURE II), частоту персистуючих інфекцій та захворювань, пов’язаних з ВПЛ 6, 11, 16 або 18 (протокол 007), а також частоту пов’язаної з ВПЛ 16 персистуючої інфекції (протокол 005). Наприкінці дослідження середня тривалість періоду спостереження за особами, зареєстрованими у цих двох дослідженнях III фази (протокол-013 і протокол-015) склала до 4 років (у середньому 3,7 року).1
Дослідження FUTURE III: ефективність Гардасилу® у жінок віком від 24 до 45 років оцінювали в 1 плацебо-контрольованому, подвійному сліпому, рандомізованому клінічному дослідженні III фази (протокол 019, FUTURE III), в якому брали участь загалом 3817 жінок, яких включали у дослідження та вакцинували без проведення попереднього скринінгу на наявність ВПЛ-інфекції. Основні кінцеві параметри ефективності включали об’єднану частоту персистуючої інфекції, пов’язаної з ВПЛ 6, 11, 16 або 18, об’єднану частоту персистуючої інфекції, пов’язаної з ВПЛ 16 або ВПЛ 18 (визначення через 6 місяців), частоту генітальних бородавок, вульварних та вагінальних уражень, CIN будь-якого ступеня, аденокарциноми in situ та раку шийки матки. Середня тривалість періоду спостереження у цьому дослідженні становила 4,0 роки.1
Ефективність у чоловіків віком 16-26 років**
68.1 %
(95 % ДІ: 48.8, 79.3)
Проти пов’язаних з ВПЛ 6-, 11-, 16-, 18- генітальних кондилом
54.2 %
(95 % ДІ: 18.0, 75.3; 18/275 проти 39/276)
Проти пов’язаних з ВПЛ 6-, 11-, 16-, 18- випадків анальної інтраепітеліальної неоплазії AIN 2/3
*Ефективність Гардасилу® у чоловіків віком від 16 до 26 років оцінювали в 1 плацебо-контрольованому, подвійному сліпому, рандомізованому клінічному дослідженні III фази (протокол 020), в якому брали участь загалом 4055 чоловіків, яких включали у дослідження та вакцинували без проведення попереднього скринінгу на наявність ВПЛ-інфекції. Ефективність оцінювали проти пов’язаних з ВПЛ 6, 11, 16, 18 зовнішніх генітальних бородавок, випадків інтраепітеліальної неоплазії статевого члена/промежини/ перианальної інтраепітеліальної неоплазії (PIN) 1-го/2-го/3-го ступеня та випадків персистуючої інфекції.1
AIN= анальна інтраепітеліальна неоплазія
AIS= аденокарцинома in situ
CIN= інтраепітеліальна неоплазія шийки матки
HPV(ВПЛ) = вірус папіломи
EGL = ураження зовнішніх статевих органів
VIN= інтраепітеліальна неоплазія вульви
aНе всі випадки раку шийки матки, вульви, піхви та анального каналу викликаються вірусом ВПЛ.1
Ефективність ГАРДАСИЛУ® проти персистуючої інфекції та захворювань, пов’язаних з 6, 11, 16 та 18 типами ВПЛ
У плацебо-контрольованому, подвійному сліпому, рандомізованому клінічному дослідженні III фази, що включало загалом 3817 жінок, що тривало протягом 4 років, ГАРДАСИЛ® вводили жінкам віком 24 до 45 років, не інфікованим ВПЛ типів 6, 11, 16 або 18, з проведенням оцінки через 1 місяць після введення дози 3 (місяць 7)1:

З ВПЛ 6, 11, 16 або 18 типів пов’язані
випадки персистуючої інфекції, генітальних
кондилом, ураження вульви та піхви, CIN
будь-якого ступеня, аденокарциноми in situ
та раку шийки матки

З ВПЛ 16 або 18 типів пов’язані випадки
персистуючої інфекції, генітальних
кондилом, ураження вульви та піхви, CIN
будь-якого ступеня, аденокарциноми in
situ та раку шийки матки
Раннє застосування ГАРДАСИЛУ® сприяє розвитку імуногенності у молодих жінок
ГАРДАСИЛ® можна вводити дітям віком від 9 років, щоб захистити їх від декількох типів ВПЛ.2
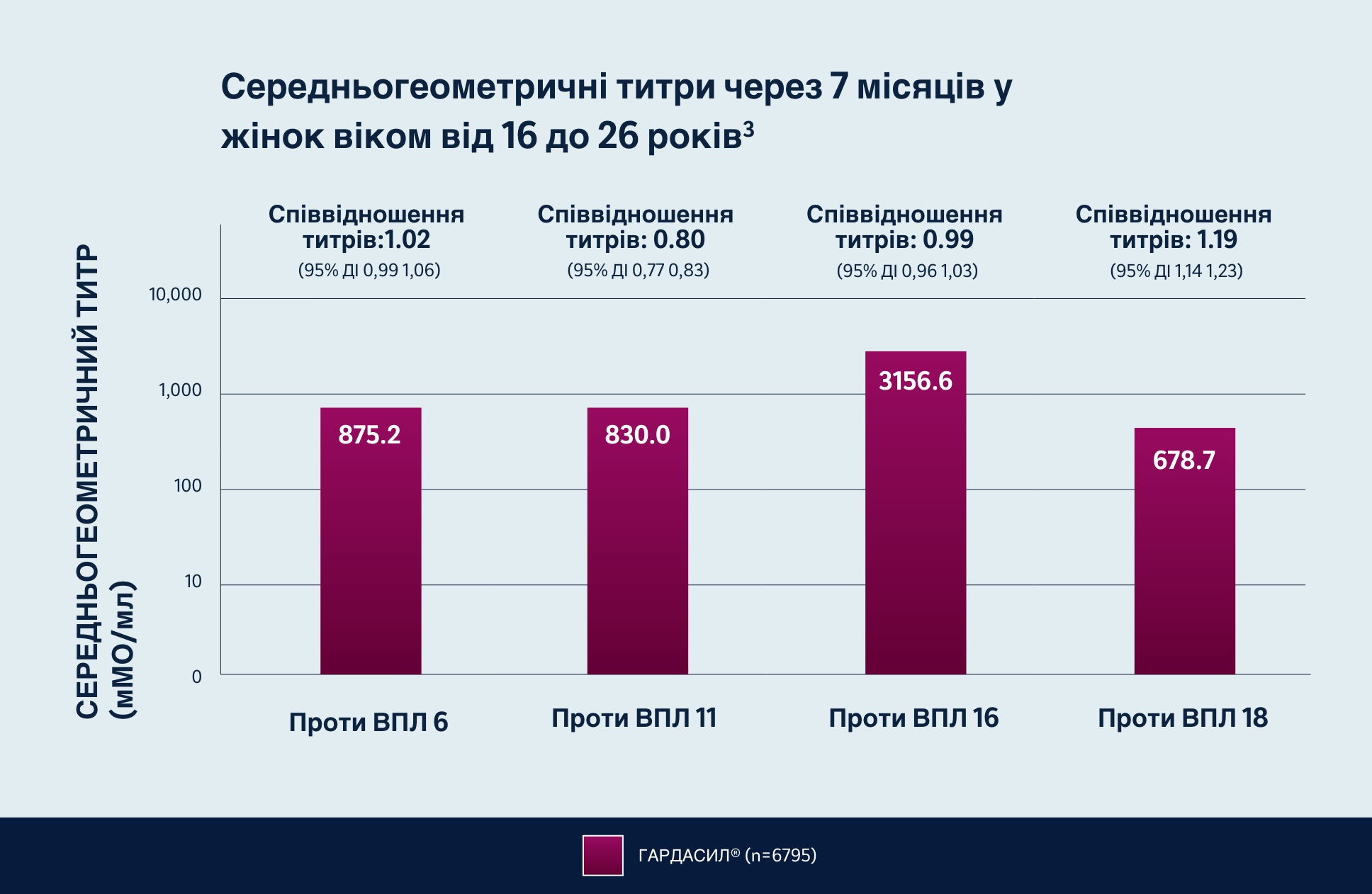
Рандомізоване, міжнародне, подвійне сліпе дослідження фази 2b-3 за участю 14 215 жінок із застосуванням дев’ятивалентної або чотирьохвалентної вакцини проти ВПЛ.
Учасникам вводили дев’ятивалентну або чотиривалентну вакцину проти ВПЛ у серії з трьох внутрішньом’язових ін’єкцій у 1-й день, а потім через 2 місяці та 6 місяців. Для аналізу відповіді антитіл брали зразки сироватки крові. Популяція для оцінки імуногенності згідно з протоколом включала учасників із популяції для аналізу ефективності згідно з протоколом, яким ввели три дози вакцини при дотриманні заздалегідь визначених інтервалів між візитами та у яких взяли 7-місячний зразок сироватки крові протягом заздалегідь визначеного інтервалу. P<0,001 для всіх порівнянь між дев’ятивалентною вакциною проти ВПЛ та чотиривалентною вакциною проти ВПЛ.
Література:
- Інструкція для медичного застосування лікарського засобу Гардасил / Gardasil
- Joura EA, et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med.2015;372:711–723

