Недрібноклітинний Рак Легень

Кітруда® (пембролізумаб) – 1-ша лінія лікування метастатичного недрібноклітинного раку легень
*без EGFR- чи ALK-мутацій
Для отримання додаткової інформації про дослідження KEYNOTE для mNSCLC відвідайте сторінки нижче:
1L = first line; 2L = second line; ALK = Anaplastic Lymphoma Kinase; EGFR = Epidermal Growth Factor Receptor; mNSCLC = metastatic Non-Small Cell Lung Cancer; PD-L1 = Programmed Death-Ligand 1; Q3W = 3-weekly dosing; Q6W = 6-weekly dosing; TPS = Tumor Proportion Score
- Reck M, Rodríguez-Abreu D, Robinson AG, et al. Five-year outcomes with pembrolizumab versus chemotherapy for metastatic non-small-cell lung cancer with PD-L1 tumor proportion score ≥50%. J Clin Oncol. 2021;39(21):2339–2349.
- Gadgeel S, Rodríguez-Abreu D, Speranza G, et al. Updated analysis from KEYNOTE-189: pembrolizumab or placebo plus pemetrexed and platinum for previously untreated metastatic non-squamous non-small-cell lung cancer. J Clin Oncol. 2020;38(14):1505–1517.
- Robinson AG et al. Presented at ELCC Congress 2021; March 27–October 1, 2019; virtual. Abstract FP97O.
- Herbst RS et al. Five year survival update from KEYNOTE-010: pembrolizumab versus docetaxel for previously treated, programmed death-ligand 1-positive avanced NSCLC. J Thorac Oncol. 2021 Oct;16(10):1718-1732.
- SmPC Keytruda® 10/2021.


KEYNOTE-189
Дослідження 3 фази з вивчення пеметрекседу + хіміотерапії препаратом платини ± пембролізумабу, що застосовуються як терапія першої лінії (1L) при метастатичному неплоскоклітинному недрібноклітинному раку легень (НДКРЛ)2
Дослідження 3 фази у пацієнтів із неплоскоклітинним мНДКРЛ (n = 616)
Основні критерії придатності пацієнтів для включення у дослідження
- Вік ≥ 18 років
- Відсутність в анамнезі попереднього системного лікування з приводу метастатичного неплоскоклітинного НДКРЛ
- Відсутність EGFR та ALK мутацій
- ECOG на рівні 0 або 1 балу
- Будь-який статус за експресією PD-L1
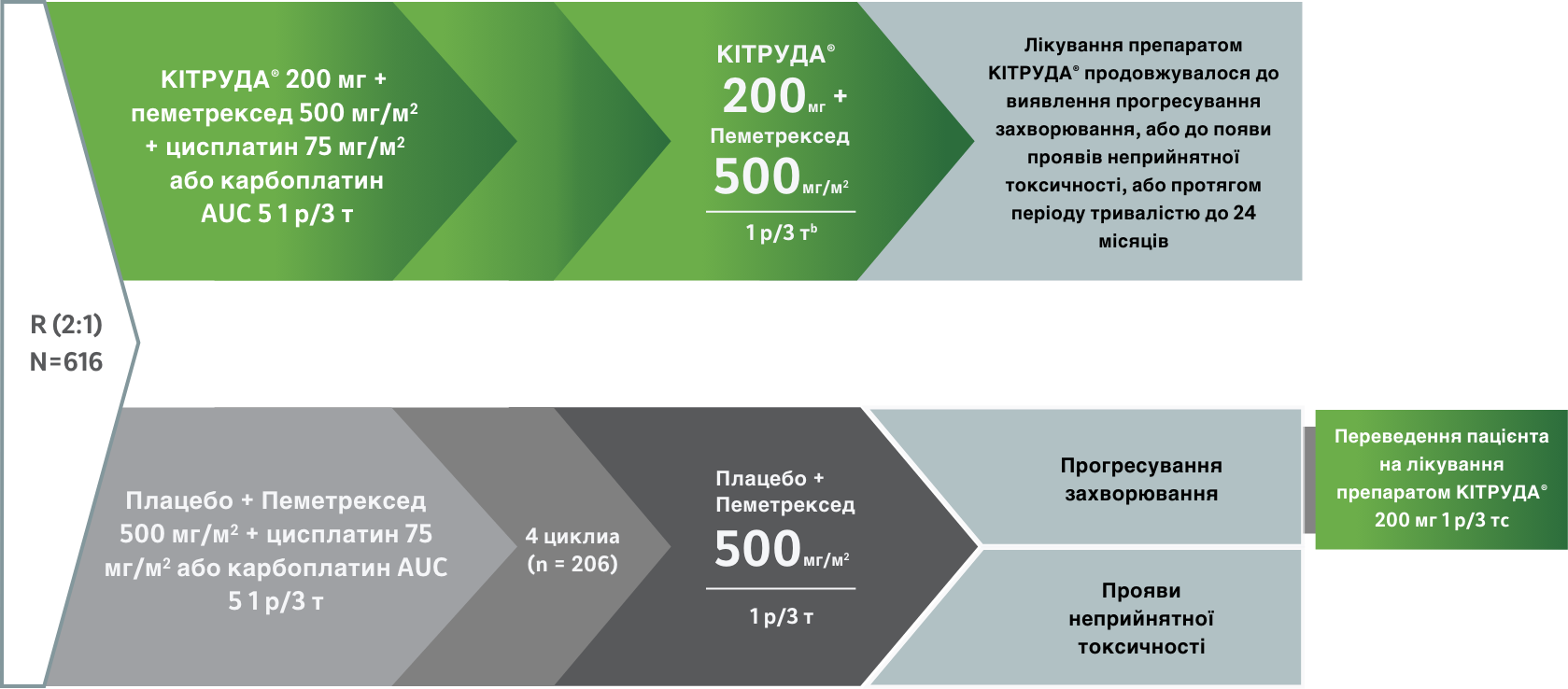
- Основні показники ефективності: загальна виживаність (ЗВ) і виживаність без прогресування (ВБП), за результатами BICR (Незалежної централізованої експертної оцінки в сліпому режимі) за критеріями RECIST (Критерії оцінки відповіді на лікування при солідних пухлинах) 1.1.2
- Другорядні показники ефективності: частота об’єктивної відповіді на лікування (ЧОВ) і тривалість відповіді на лікування (ТВЛ), за оцінкою BICR за критеріями RECIST 1.1.2
- Пацієнти стратифікувалися за експресією ліганда програмованої смерті клітин 1 типу (PD-L1) (TPS < 1%; TPS ≥ 1%), в залежності від того, який препарат платини вони отримували (цисплатин або карбоплатин), і в залежності від наявності тютюнопаління в анамнезі (курці vs особи, що ніколи не палили / курці на даний час).2
- Пацієнти з аутоімунним захворюванням, які потребували системної терапії у межах 2 років до початку досліджуваного лікування; пацієнти з медичним станом, що потребував імуносупресії; та пацієнти, які отримали більше ніж 30 Гр опромінення грудної клітки у межах 6 місяців перед введенням першої дози досліджуваного препарату, не допускалися до участі у дослідженні.2
a Усі пацієнти отримали до 4 циклів терапії (на вибір дослідника) цисплатином у дозі 75 мг/м2 або карбоплатином у дозі, яка забезпечує AUC на рівні 5 мг/мл/хв, + пеметрексед у дозі 500 мг/м2, які усі вводилися внутрішньовенно один раз на три тижні (1 р/3 т), з подальшим застосуванням пеметрекседу у дозі 500 мг/м2 1 р/3 т.2
b Препарат КІТРУДА® або плацебо призначалися 1 р/3 т протягом загалом до 35 циклів на фоні підтримувальної терапії пеметрекседом.2
c Пацієнти в групі отримання лише препарату платини / пеметрекседу (плат/пем), у яких було відмічене прогресування захворювання, верифіковане за результатами BICR, могли бути переведені в групу отримання препарату КІТРУДА® як монотерапії.2
ALK = кіназа анапластичної лімфоми; AUC = площа під кривою «концентрація/час»; BICR = Незалежна централізована експертна оцінка в сліпому режимі; ТВЛ = тривалість відповіді на лікування; ECOG = Східна об’єднана онкологічна група; EGFR = рецептор епідермального фактора росту; мНДКРЛ = метастатичний недрібноклітинний рак (карцинома) легень; ЧОВ = частота об’єктивної відповіді на лікування; ЗВ = загальна виживаність; PD-L1 = ліганд програмованої смерті клітин 1 типу; ВБП = виживаність без прогресування захворювання; плат/пем = хіміотерапія препаратом платини / пеметрексед; 1 р/3 т = кожні 3 тижні; RECIST версії 1.1 = Критерії оцінки відповіді на лікування при солідних пухлинах; TPS = Шкала відсотка експресії PD-L1 в пухлині
Список літератури:
- Garassino MC, Gadgeel S, Speranza G, et al. Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the Phase 3 KEYNOTE-189 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01989
- Rodríguez-Abreu D, Powell SF, Hochmair MJ, et al. Pemetrexed plus platinum with or without pembrolizumab in patients with previously untreated metastatic nonsquamous NSCLC: protocol-specified final analysis from KEYNOTE-189. Ann Oncol. 2021;32(7):881–895.
У ITT популяції (прихильні до лікування) пацієнтів:
загальна виживаність
Оновлений аналіз 5-річних даних дослідження KEYNOTE-189
При неплоскоклітинному мНДКРЛ без геномних аберацій EGFR або ALK в пухлині1
Медіана тривалості спостереження: 64,6 місяця (діапазон: 60,1 – 72,4)2
ОБМЕЖЕННЯ: Оновлений post-hoc аналіз у рамках дослідження KEYNOTE-189 був пошуковим за своїм характером і був виконаний після початкового аналізу (медіана тривалості спостереження: 64,6 місяця); у зв’язку з цим не можуть бути зроблені жодні статистичні висновки. Жодного формального статистичного тестування для цього оновленого аналізу заплановано не було, тому не можуть бути зроблені жодні статистичні висновки. Учасники дослідження в обох досліджуваних групах могли отримувати подальшу протипухлинну терапію.2
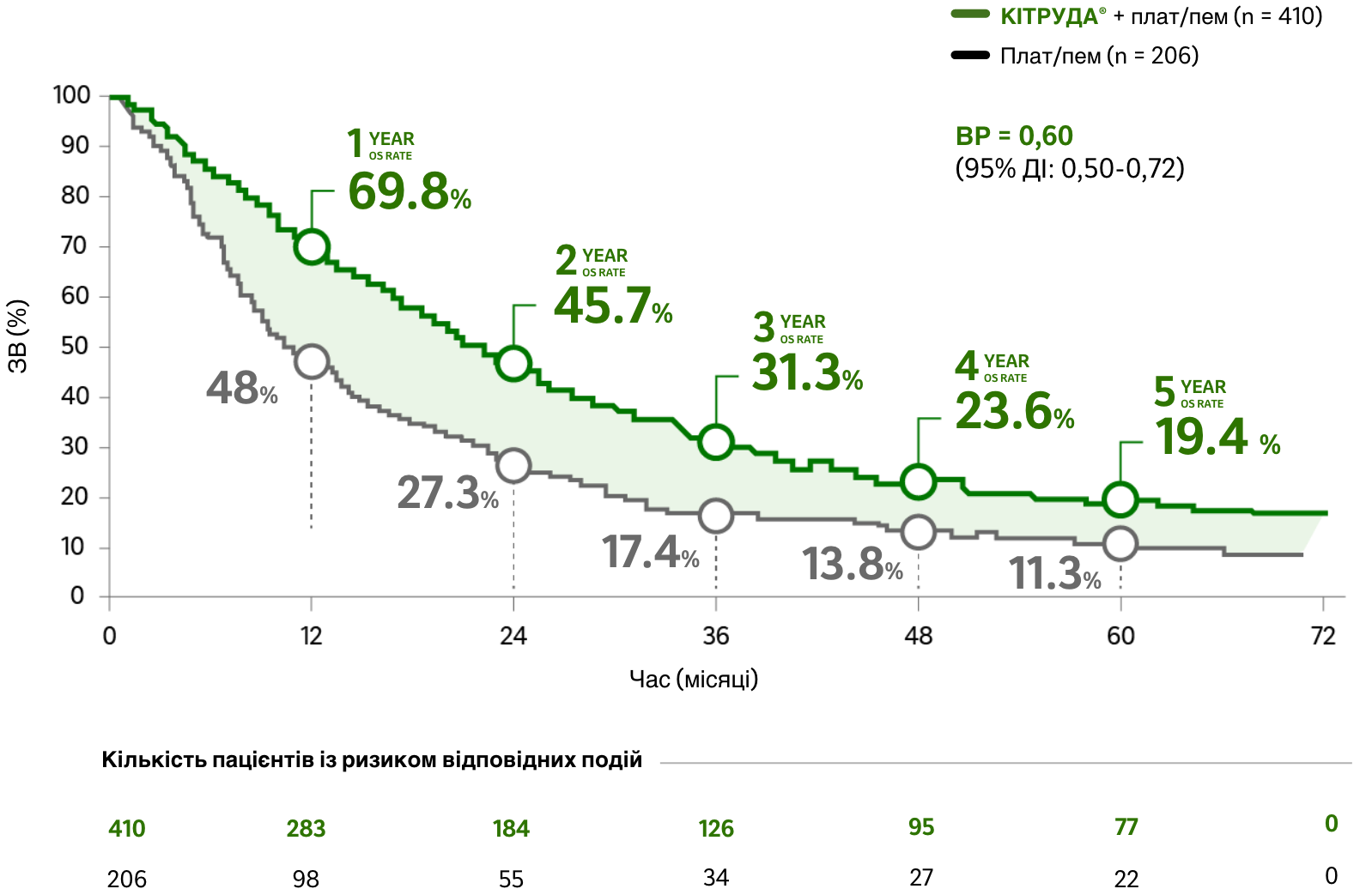

Зниження ризику смерті
на фоні застосування препарату КІТРУДА® + плат/пем у порівнянні з лише плат/пем
(ВР = 0,60 [95% ДІ: 0,50-0,72])
ЗВ на фоні застосування препарату КІТРУДА® + плат/пем у порівнянні з лише плат/пем при неплоскоклітинному мНДКРЛ (пошуковий аналіз)2,a
Медіана ЗВ2

ЧАСТОТА ПЕРЕВЕДЕННЯ ПАЦІЄНТІВ МІЖ ГРУПАМИ ЛІКУВАННЯ: 57,3% пацієнтів (118/206) були переведені з групи отримання плат/пем в групу отримання анти-PD-L1 терапії під час дослідження (n = 84) або після завершення дослідження (n = 34)2,b
У ITT популяції (прихильні до лікування) пацієнтів:
виживаність без прогресування (ВБП) захворювання
ВБП на фоні застосування препарату КІТРУДА® + плат/пем у порівнянні з лише плат/пем (пошуковий аналіз)2,a,с
ОБМЕЖЕННЯ: Оновлений post-hoc аналіз (медіана тривалості спостереження: 64,6 місяця) у рамках дослідження KEYNOTE-189 був пошуковим за своїм характером і був виконаний після визначеного протоколом остаточного аналізу. Жодного формального статистичного тестування для цього оновленого аналізу заплановано не було, тому не можуть бути зроблені жодні статистичні висновки. Учасники дослідження в обох досліджуваних групах могли отримувати подальшу протипухлинну терапію.2
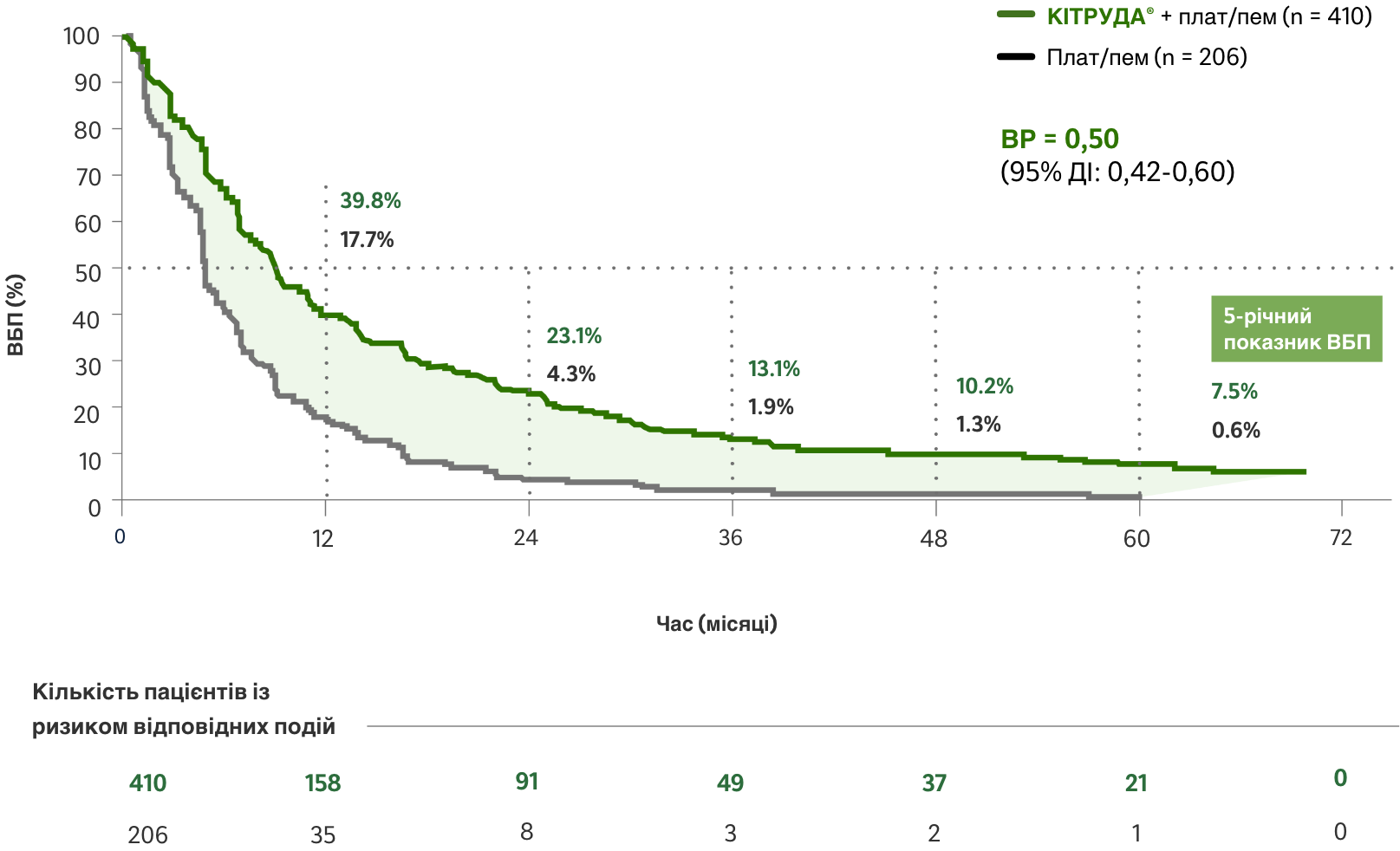

Зниження ризику
прогресування
захворювання
на фоні застосування препарату КІТРУДА® + хіміотерапії у порівнянні з лише хіміотерапією
HR = 0.50; 95 CI; 0.42 – 0.60
Медіана ВБП2,c
a Оцінка Каплана-Мейєра. Дата зрізу даних: 8 березня 2022 року.2
b Деякі пацієнти отримували в подальшому > 1 анти-PD-L1 препарату.2
c За результатами BICR за критеріями RECIST версії 1.1.2
ДІ = довірчий інтервал; ПВ = повна відповідь на лікування; ВР = відношення ризиків; мНДКРЛ = метастатичний недрібноклітинний рак(карцинома) легень; ЧОВ = частота об’єктивної відповіді на лікування; ВБП = виживаність без прогресування захворювання; плат/пем = карбоплатин або цисплатин і пеметрексед; RECIST версії 1.1 = Критерії оцінки відповіді на лікування при солідних пухлинах, версія 1.1
Список літератури:
- Gandhi L, Rodriguez-Abreu D, Gadgeel S, et al; for the KEYNOTE-189 investigators. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N Engl J Med. 2018;378(22):2078-2092.
- Garassino MC, Gadgeel S, Speranza G, et al. Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the Phase 3 KEYNOTE-189 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01989.
Підгрупи в залежності від PD-L1 експресії:
загальна виживаність
Результати оцінки ЗВ у різних підгрупах в залежності від експресії PD-L1 за результатами оновленого пошукового аналізу даних 5-річного спостереження у рамках дослідження KEYNOTE-1891
Медіана тривалості спостереження: 64,6 місяця1
ОБМЕЖЕННЯ: Дослідження KEYNOTE-189 не мало достатньої статистичної потужності для виявлення відмінностей між ефектом лікування в цих підгрупах; у зв’язку з цим результати цих пошукових аналізів слід інтерпретувати з обережністю з огляду на невелику кількість пацієнтів і потенційну незбалансованість вихідних характеристик у цих підгрупах.1
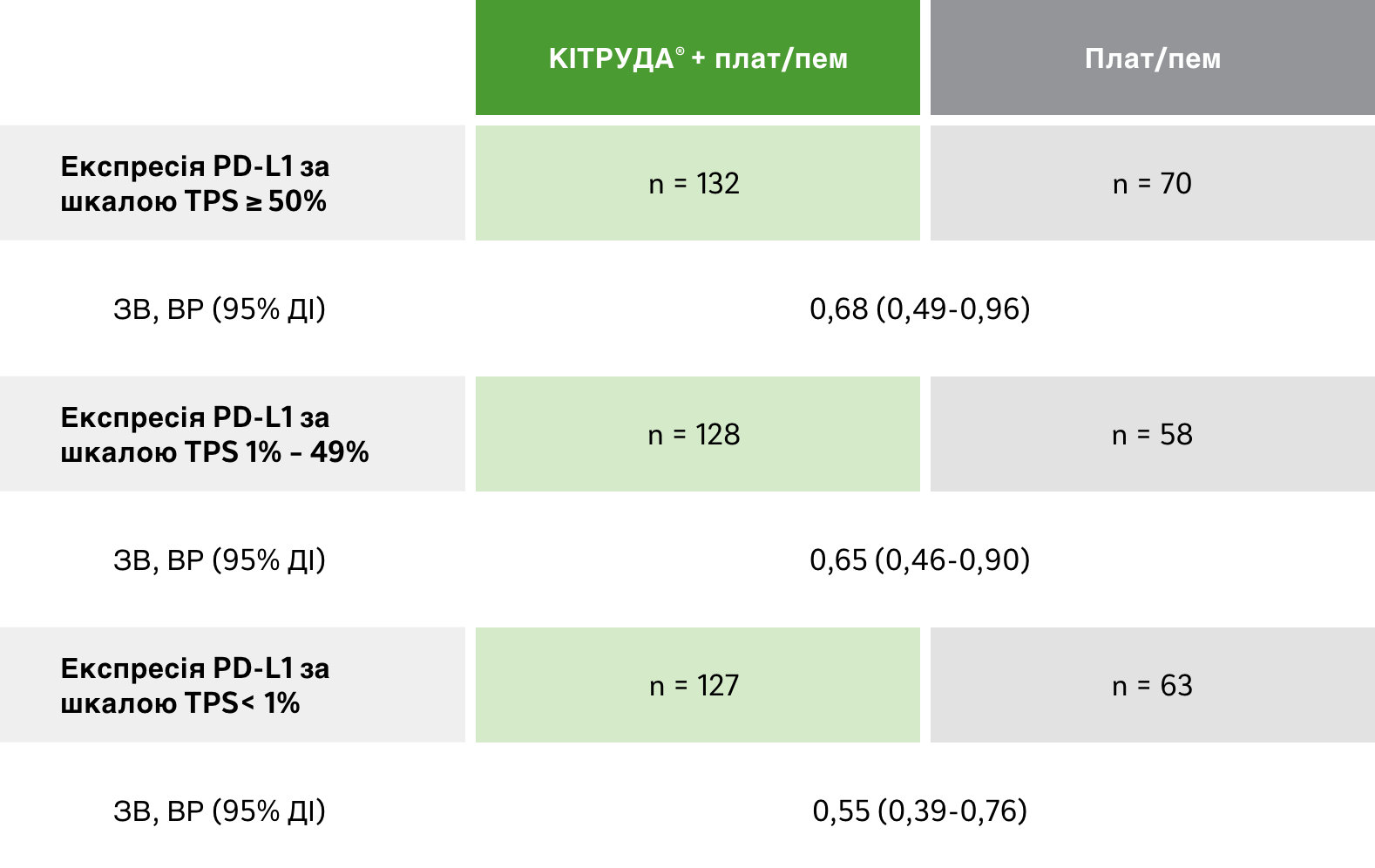
a Оцінка Каплана-Мейєра. Дата зрізу даних: 8 березня 2022 року.1
ALK = кіназа анапластичної лімфоми; ДІ = довірчий інтервал; EGFR = рецептор епідермального фактора росту; ВР = відношення ризиків; мНДКРЛ = метастатичний недрібноклітинний рак (карцинома) легень; НПК = неплоскоклітинний; ЗВ = загальна виживаність; PD-L1 = ліганд програмованої смерті клітин 1 типу; плат/пем = карбоплатин або цисплатин і пеметрексед; TPS = Шкала відсотка експресії PD-L1 в пухлині
Підгрупи в залежності від PD-L1 експресії:
ВБП захворювання
Результати оцінки ВБП у різних підгрупах в залежності від експресії PD-L1 за результатами оновленого пошукового аналізу даних 5-річного спостереження у рамках дослідження KEYNOTE-1891
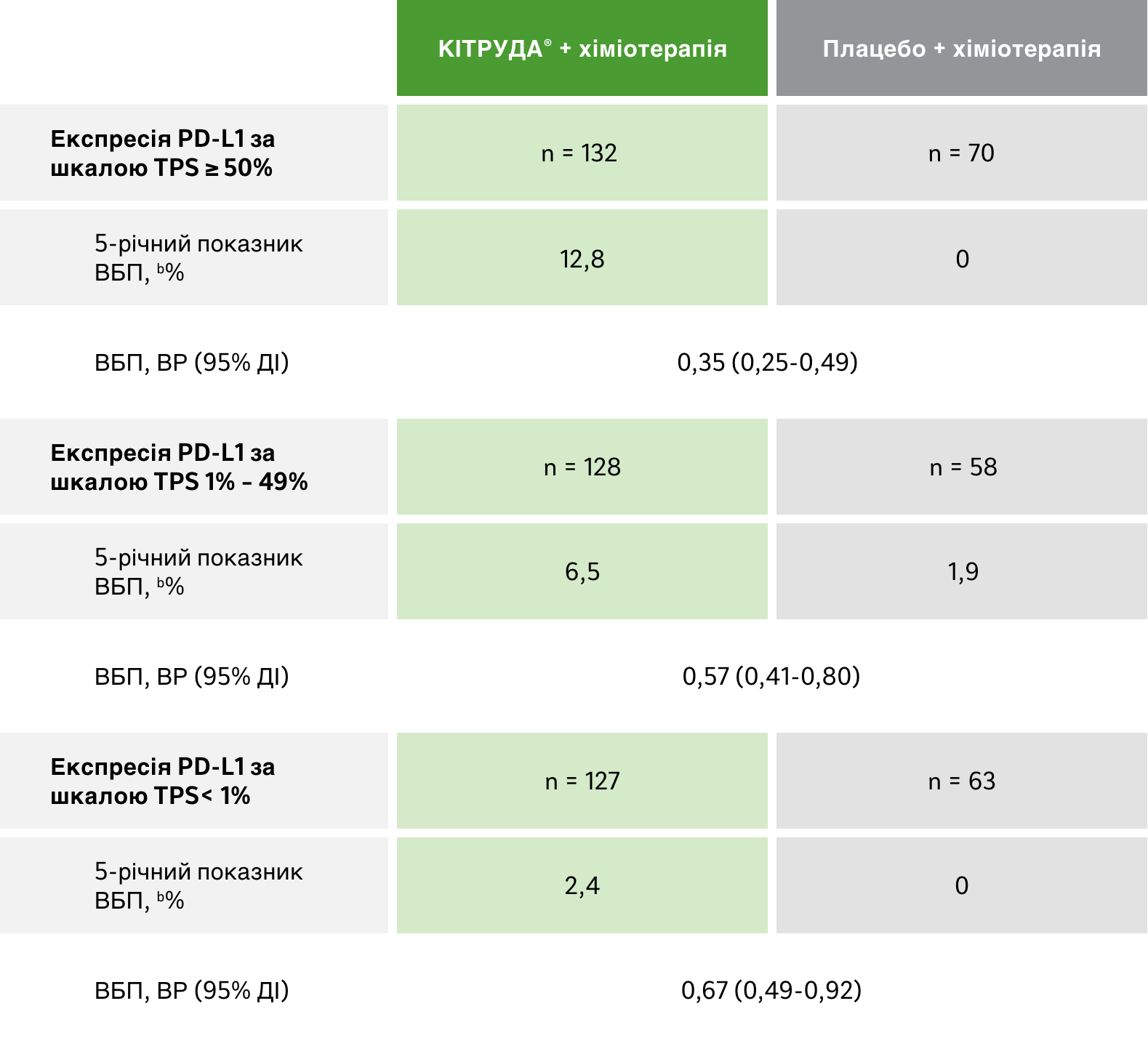
a За результатами BICR за критеріями RECIST версії 1.1.
b Оцінка Каплана-Мейєра. Дата зрізу даних: 8 березня 2022 року.
ДІ = довірчий інтервал; ВР = відношення ризиків; ЗВ = загальна виживаність; PD-L1 = ліганд програмованої смерті клітин 1 типу; ВБП = виживаність без прогресування захворювання; плат/пем = карбоплатин або цисплатин і пеметрексед; TPS = Шкала відсотка експресії PD-L1 в пухлині
Список літератури:
- Garassino MC, Gadgeel S, Speranza G, et al. Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the Phase 3 KEYNOTE-189 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01989
ЧОВ збільшилася удвічі при застосуванні препарату КІТРУДА® + препарату платини / пеметрекседу (плат/пем) у порівнянні з лише схемою плат/пем1,а
ОБМЕЖЕННЯ: Оновлений post-hoc аналіз (медіана тривалості спостереження: 64,6 місяця) у рамках дослідження KEYNOTE-189 був пошуковим за своїм характером і був виконаний після визначеного протоколом остаточного аналізу. Жодного формального статистичного тестування для цього оновленого аналізу заплановано не було, тому не можуть бути зроблені жодні статистичні висновки. Учасники дослідження в обох досліджуваних групах могли отримувати подальшу протипухлинну терапію.1
У ITT популяції (прихильні до лікування) пацієнтів:

a За результатами BICR за критеріями RECIST версії 1.1.1
BICR = Незалежна централізована експертна оцінка в сліпому режимі; ЧОВ = частота об’єктивної відповіді на лікування; плат/пем = карбоплатин або цисплатин і пеметрексед; RECIST версії 1.1 = Критерії оцінки відповіді на лікування при солідних пухлинах, версія 1.1
Список літератури:
- Garassino MC, Gadgeel S, Speranza G, et al. Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the Phase 3 KEYNOTE-189 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01989
Медіана ТВЛ на час виконання оновленого аналізуa,b
ОБМЕЖЕННЯ: Оновлений post-hoc аналіз (медіана тривалості спостереження: 64,6 місяця) у рамках дослідження KEYNOTE-189 був пошуковим за своїм характером і був виконаний після визначеного протоколом остаточного аналізу. Жодного формального статистичного тестування для цього оновленого аналізу заплановано не було, тому не можуть бути зроблені жодні статистичні висновки. Учасники дослідження в обох досліджуваних групах могли отримувати подальшу протипухлинну терапію.1
У популяції ITT:

a Оцінка Каплана-Мейєра. Дата зрізу даних: 8 березня 2022 року.1
b За результатами BICR за критеріями RECIST версії 1.1.1
плат/пем = карбоплатин або цисплатин і пеметрексед
Список літератури:
- Garassino MC, Gadgeel S, Speranza G, et al. Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the Phase 3 KEYNOTE-189 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01989
Популяція для оцінки безпечності: усі пацієнти, які отримували лікування1
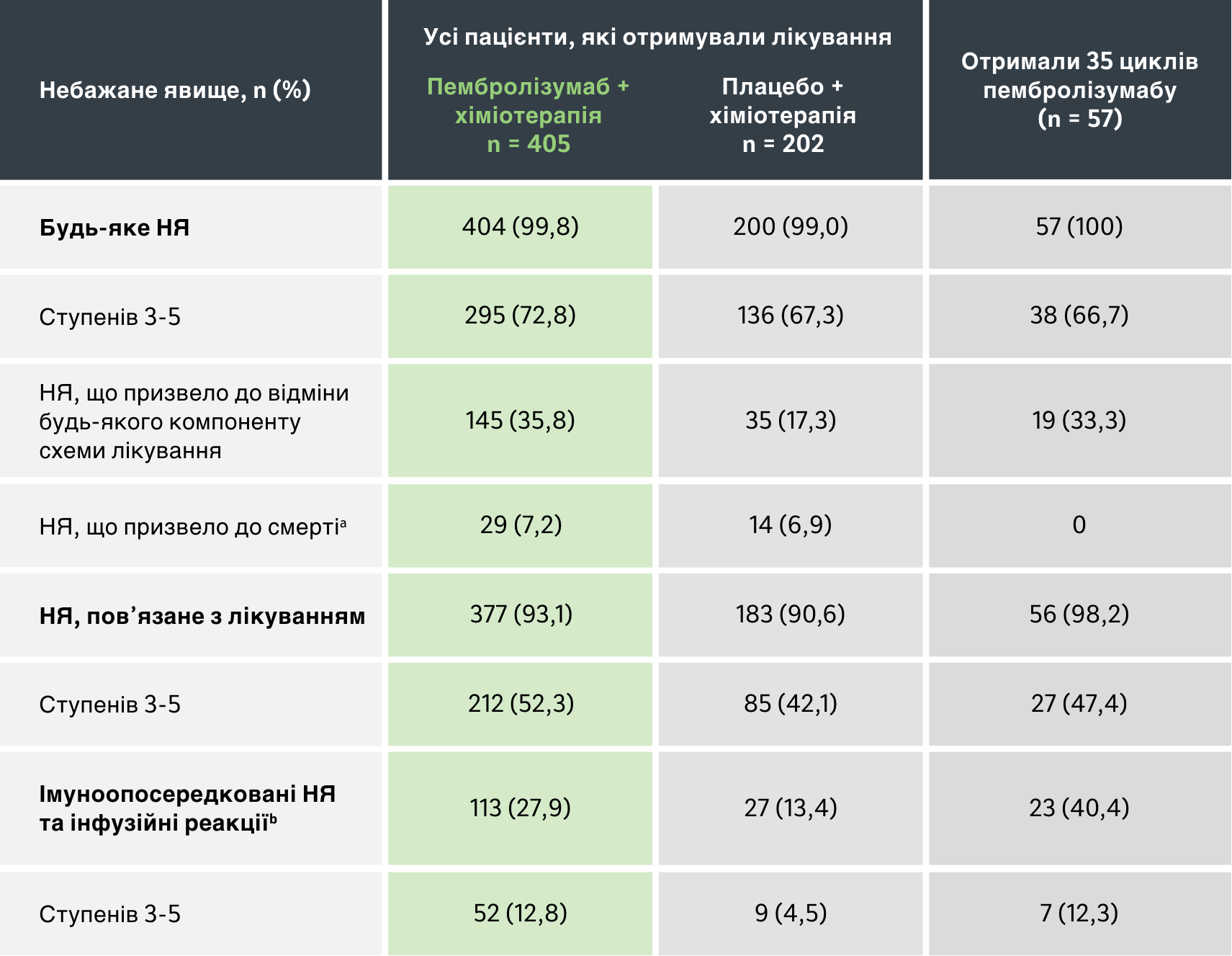
a Усі випадки смерті були раніше повідомлені в публікації Rodriguez-Abreu D, et al. Ann Oncol. 2021;32(7):881-895
b Події враховуються незалежно від того, чи дослідник розцінює їх пов’язаними з лікуванням або імуноопосередкованими. Дата зрізу даних: 8 березня 2022 року.
Список літератури:
- Garassino MC, Gadgeel S, Speranza G, et al. Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the Phase 3 KEYNOTE-189 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01989
Список літератури
- Garassino MC, Gadgeel S, Speranza G, et al. Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the Phase 3 KEYNOTE-189 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01989
UA-KEY-00351 | Дата затвердження: 10.2023 | Матеріал дійсний до: 09.2025


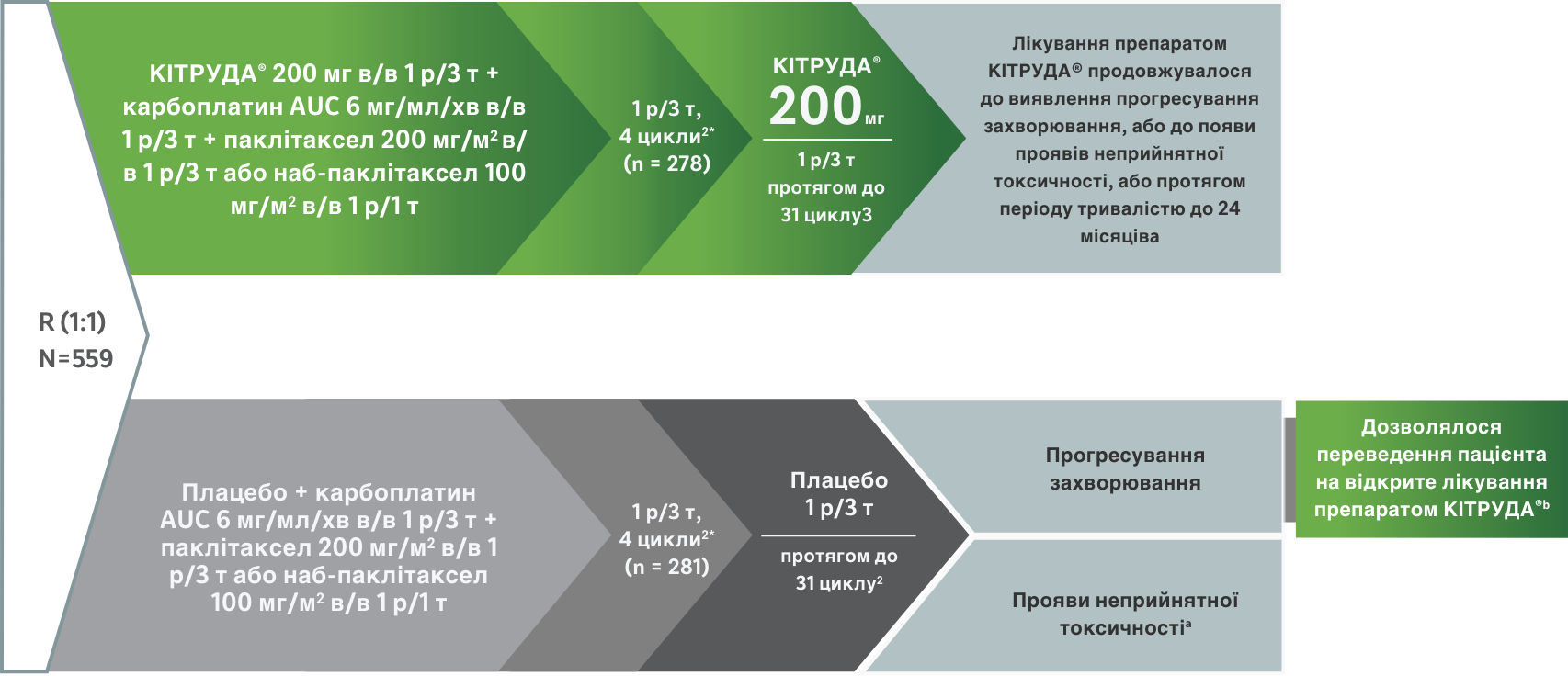
KEYNOTE-407
Дослідження 3 фази з вивчення карбоплатину + паклітакселу / наб-паклітакселу ± пембролізумабу, що застосовуються як терапія першої лінії (1L) у пацієнтів із плоскоклітинним недрібноклітинним раком легень (НДКРЛ) IV стадії1
Дослідження 3 фази у пацієнтів із плоскоклітинним мНДКРЛ (n = 559)1
Основні критерії придатності пацієнтів для включення у дослідження
- Вік ≥ 18 років
- Відсутність в анамнезі попереднього системного лікування з приводу метастатичного захворювання
- ECOG на рівні 0 або 1 балу
- Основні показники ефективності: загальна виживаність (ЗВ); виживаність без прогресування (ВБП), за оцінкою BICR (Незалежної централізованої експертної оцінки в сліпому режимі) за критеріями RECIST (Критерії оцінки відповіді на лікування при солідних пухлинах) версії 1.12
- Другорядні показники ефективності: частота об’єктивної відповіді на лікування (ЧОВ) і тривалість відповіді на лікування (ТВЛ), за оцінкою BICR за критеріями RECIST версії 1.12
- Пацієнти були стратифіковані за статусом експресії PD-L1 у пухлині (TPS < 1% або TPS ≥ 1%) залежно від вибору таксану (паклітаксел або набпаклітакселу) та географічного регіону реєстрації (Східна Азія і решта світу).1
- Пацієнти з симптоматичний метастазами в центральній нервовій системі; пацієнти з наявністю в анамнезі неінфекційного пневмоніту, що вимагав застосування системних глюкокортикоїдів; пацієнти з активним аутоімунним захворюванням; пацієнти, які отримують системне імуносупресивне лікування; та пацієнти з відомою активною інфекцією вірусу гепатиту В або С не допускалися до участі у дослідженні.2
*У перші 4 цикли усі пацієнти також отримували карбоплатин (у дозі, розрахованій таким чином, щоб вона забезпечувала площу від кривою «концентрація/час» на рівні 6 мг на мілілітр на хвилину) у День 1 і або паклітаксел (200 мг на квадратний метр площі поверхні тіла) у День 1, або наб-паклітаксел (100 мг на квадратний метр площі поверхні тіла) у Дні 1, 8 і 15. Усі препарати вводилися внутрішньовенно у рамках 3-тижневих циклів.
a Застосування препарату КІТРУДА® дозволялося і після виявлення прогресування захворювання за критеріями RECIST, якщо пацієнт був клінічно стабільний і за оцінкою дослідника отримував клінічну користь від такого лікування.1
b Пацієнти в групі отримання лише хіміотерапії, у яких було відмічене прогресування захворювання, верифіковане за оцінкою BICR за критеріями RECIST версії 1.1, могли бути переведені в групу отримання препарату КІТРУДА® як монотерапії.1
AUC = площа під кривою «концентрація/час»; BICR = Незалежна централізована експертна оцінка в сліпому режимі; ТВЛ = тривалість відповіді на лікування; ECOG = Східна об’єднана онкологічна група; в/в = внутрішньовенно; EGFR = рецептор епідермального фактора росту; мНДКРЛ = метастатичний недрібноклітинний рак (карцинома) легень; ЧОВ = частота об’єктивної відповіді на лікування; PD-L1 = ліганд програмованої смерті клітин 1 типу; ВБП = виживаність без прогресування захворювання; 1 р/1 т = один раз на тиждень; 1 р/3 т = кожні 3 тижні; RECIST версії 1.1 = Критерії оцінки відповіді на лікування при солідних пухлинах; TPS = Шкала відсотка експресії PD-L1 в пухлині
Список літератури:
1. Paz-Ares L, Luft A, Vicente D, et al; for the KEYNOTE-407 investigators. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer. N Engl J Med. 2018;379(21):2040– 2051.
2. Protocol for: Paz-Ares L, Luft A, Vincente D, et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer. N Engl J Med. 2018;379(21): 2040–2051. doi:10.1056/NEJMoa1810865
У загальній популяції пацієнтів: загальна виживаність
Оновлений аналіз 5-річних даних дослідження KEYNOTE-407 (пошуковий аналіз)
Терапія першої лінії при плоскоклітинному мНДКРЛ
Медіана тривалості спостереження: 56,9 (діапазон: 49,9-66,2) місяців1,c
ОБМЕЖЕННЯ: Оновлений post-hoc аналіз (медіана тривалості спостереження: 56,9 місяцяb) у рамках дослідження KEYNOTE-407 був пошуковим за своїм характером і був виконаний після виконання проміжного аналізу (медіана тривалості спостереження: 7,8 місяцяc). Ніякого формального статистичного тестування для цього оновленого аналізу заплановано не було, тому не можуть бути зроблені ніякі статистичні висновки.1
Стійке покращення ЗВ через 5 років лікування препаратом КІТРУДА® + карбоплатином (карбо) + паклітакселом/наб-паклітакселом (пак/наб-пак) у порівнянні з лікуванням карбо + пак/наб-пак1,c
Медіана тривалості спостереження: 56,9 місяця, пошуковий аналіз1,c
У загальній популяції пацієнтів:
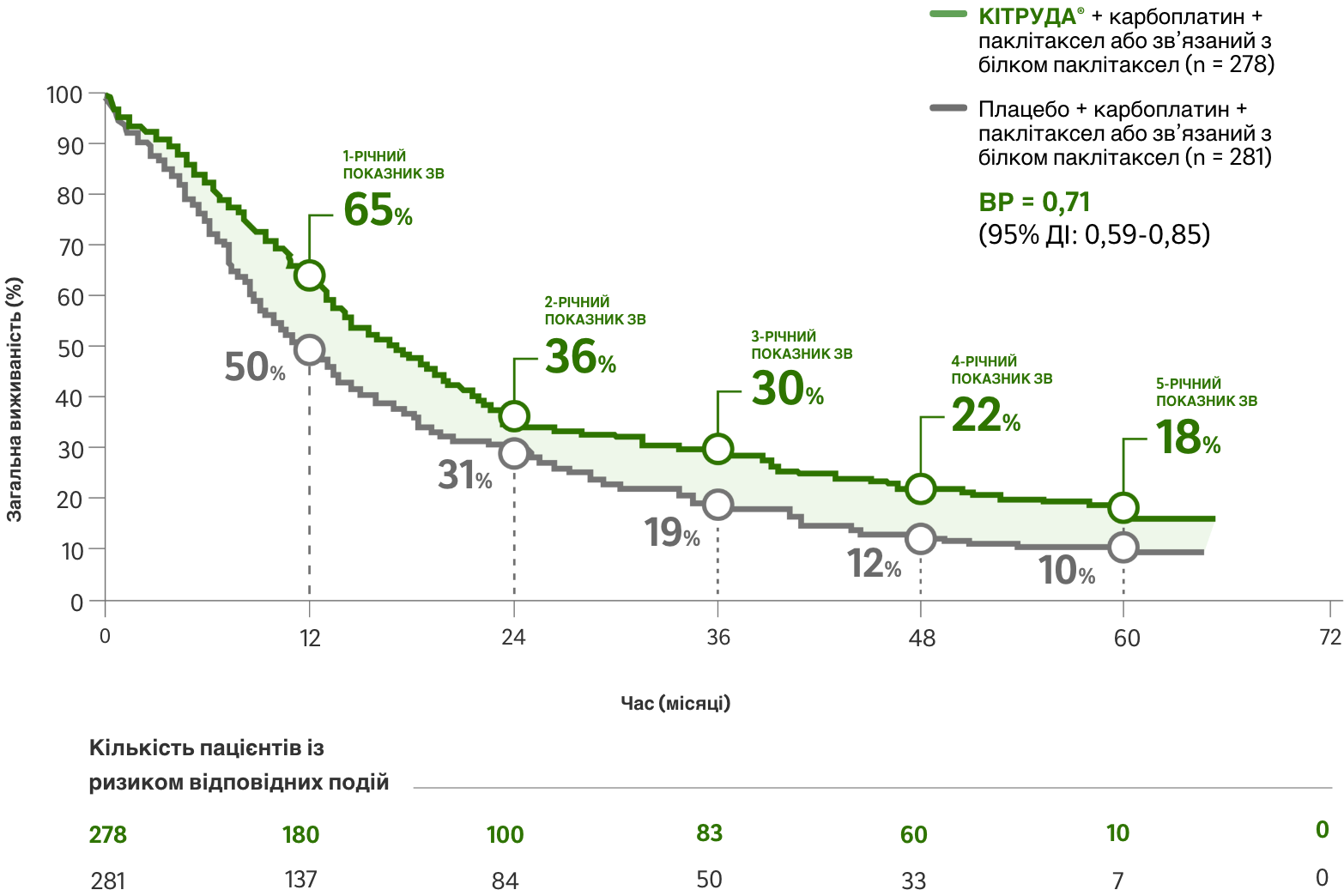

Зниження ризику смерті
на фоні застосування препарату КІТРУДА® + карбо + пак/наб-пак у порівнянні з лише карбо + пак/наб-пак (ВР = 0,71 [95% ДІ: 0,59-0,85])
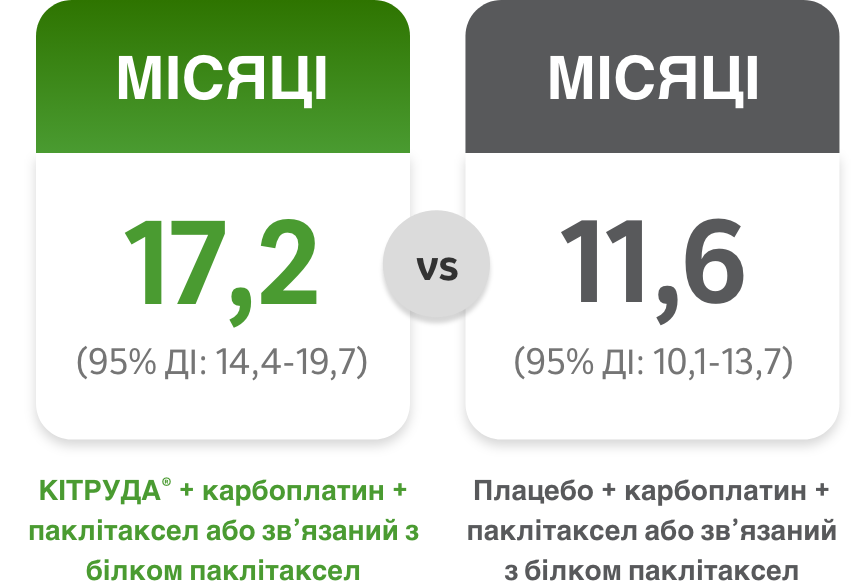
Медіана ЗВ1
ЧАСТОТА ПЕРЕВЕДЕННЯ ПАЦІЄНТІВ МІЖ ГРУПАМИ ЛІКУВАННЯ: 50,9% – 117 пацієнтів із групи плацебо + хіміотерапія перейшли на прийом пембролізумабу у вигляді монотерапії у рамках дослідження, і ще 26 пацієнтів отримували в подальшому терапію інгібіторами PD-(L)1 за межами цього дослідження.1
a Час від рандомізації до смерті або до дати зрізу даних для тих пацієнтів, які залишалися живими.1
b Показник ВР визначався на основі стратифікованої моделі пропорційних ризиків Кокса; P-значення розраховувалося за результатами стратифікованого лог-рангового тесту.1
c Час від рандомізації до дати зрізу даних.2
d Оцінка Каплана-Мейєра. Дата зрізу даних: 23 лютого 2022 року.2
карбо + пак/наб-пак = карбоплатин + паклітаксел або наб-паклітаксел; ДІ = довірчий інтервал; ВР = відношення ризиків; мНДРЛ = метастатичний недрібноклітинний рак (карцинома) легень; ЧОВ = частота об’єктивної відповіді на лікування; н/д = дані не доступні; ЗВ = загальна виживаність; PD-L1 = ліганд програмованої смерті клітин 1 типу; ВБП = виживаність без прогресування захворювання
У загальній популяції пацієнтів:
виживаність без прогресування (ВБП) захворювання
Показник ВБП на фоні лікування препаратом КІТРУДА® + карбо + пак/наб-пак у порівнянні з лікуванням карбо + пак/наб-пак1,c
ВР = 0,62; 95% ДІ (0,52-0,74)c,d
ОБМЕЖЕННЯ: Цей оновлений post-hoc аналіз (медіана тривалості спостереження: 56,9 місяцяc) у рамках дослідження KEYNOTE-407 був пошуковим за своїм характером і був виконаний після виконання проміжного аналізу (медіана тривалості спостереження: 7,8 місяцяd). Ніякого формального статистичного тестування для цього оновленого аналізу заплановано не було, тому не можуть бути зроблені ніякі статистичні висновки. Учасники дослідження в обох досліджуваних групах могли отримувати подальшу протипухлинну терапію.1
У загальній популяції пацієнтів:
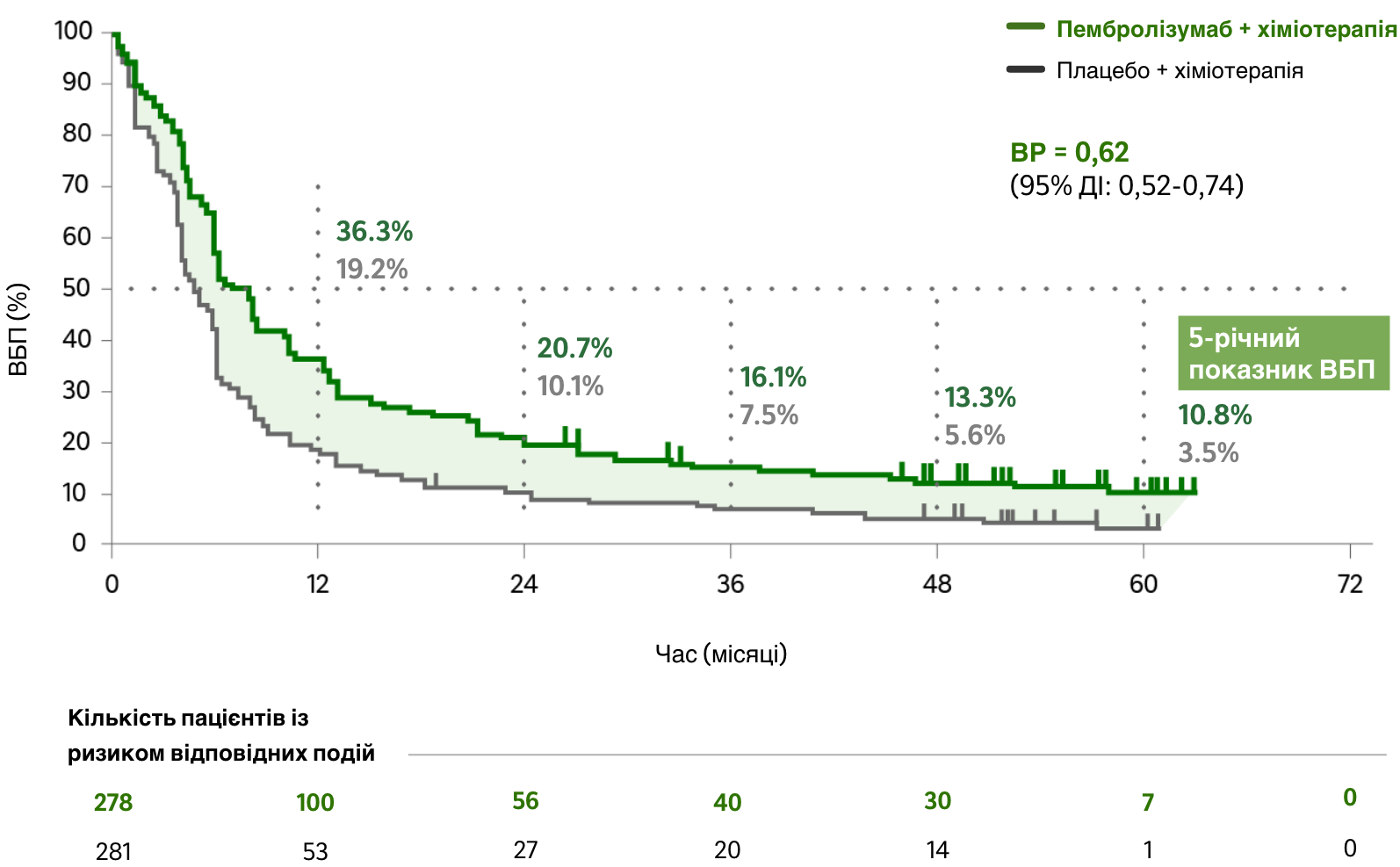

Зниження ризику прогресування захворювання
на фоні лікування препаратом КІТРУДА® + карбо + пак/наб-пак у порівнянні з лікуванням карбо + пак/наб-пак
ВР = 0,62; 95% ДІ (0,52-0,74)
Медіана ВБП1,c

a Час від рандомізації до дати зрізу даних.1
b Час від рандомізації до смерті або до дати зрізу даних для тих пацієнтів, які залишалися живими.1
c За результатами BICR за критеріями RECIST версії 1.1.1
d Оцінка Каплана-Мейєра. Дата зрізу даних: 23 лютого 2022 року.1
ДІ = довірчий інтервал; ТВЛ = тривалість відповіді на лікування; ВР = відношення ризиків; мНДКРЛ = метастатичний недрібноклітинний рак (карцинома) легень; наб-паклітаксел = зв’язаний з білком паклітаксел; ВБП = виживаність без прогресування захворювання
Список літератури:
1. Paz-Ares, Luft A, Vincente D, et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer. N Engl J Med. 2018;379(21):2040–2051. doi:10.1056/NEJMoa1810865
Підгрупи в залежності від PD-L1 експресії:
загальна виживаність
Результати оцінки ЗВ в різних підгрупах в залежності від PD-L1 експресії1
ОБМЕЖЕННЯ: Дослідження KEYNOTE-407 не мало достатньої статистичної потужності для виявлення відмінностей між ефектом лікування в цих підгрупах; у зв’язку з цим результати цих пошукових аналізів слід інтерпретувати з обережністю з огляду на невелику кількість пацієнтів і потенційну незбалансованість вихідних характеристик у цих підгрупах.1
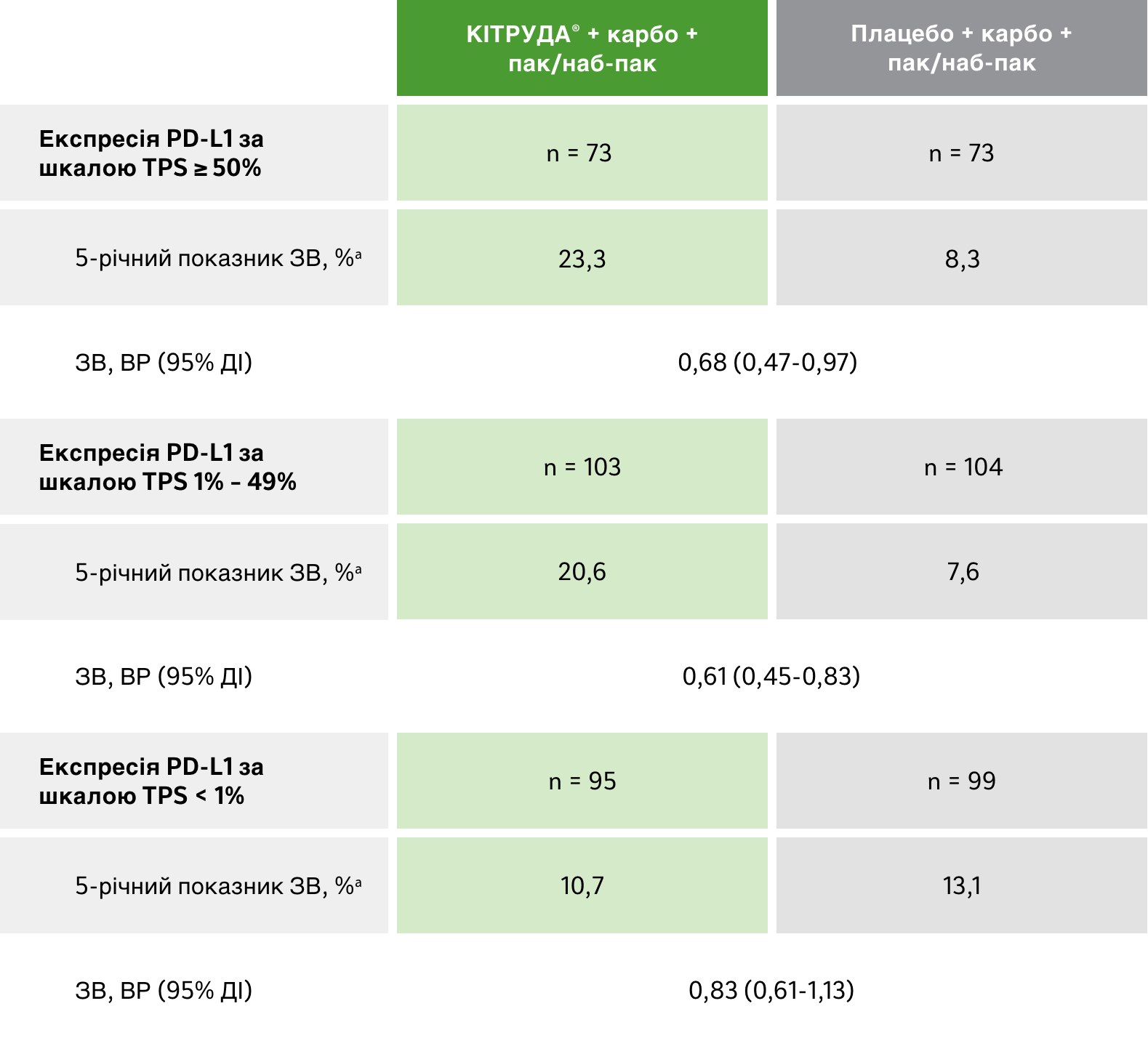
a Оцінка Каплана-Мейєра. Дата зрізу даних: 23 лютого 2022 року.1
карбо + пак/наб-пак = карбоплатин + паклітаксел або наб-паклітаксел; ДІ = довірчий інтервал; ВР = відношення ризиків; мНДРЛ = метастатичний недрібноклітинний рак (карцинома) легень; н/д = дані не доступні; ЗЧВ = загальна частота відповіді на лікування; ЗВ = загальна виживаність; PD-L1 = ліганд програмованої смерті клітин 1 типу; ВБП = виживаність без прогресування захворювання
Підгрупи в залежності від PD-L1 експресії:
ВБП захворювання
Результати оцінки ВБПa в різних підгрупах в залежності від PD-L1 експресії1
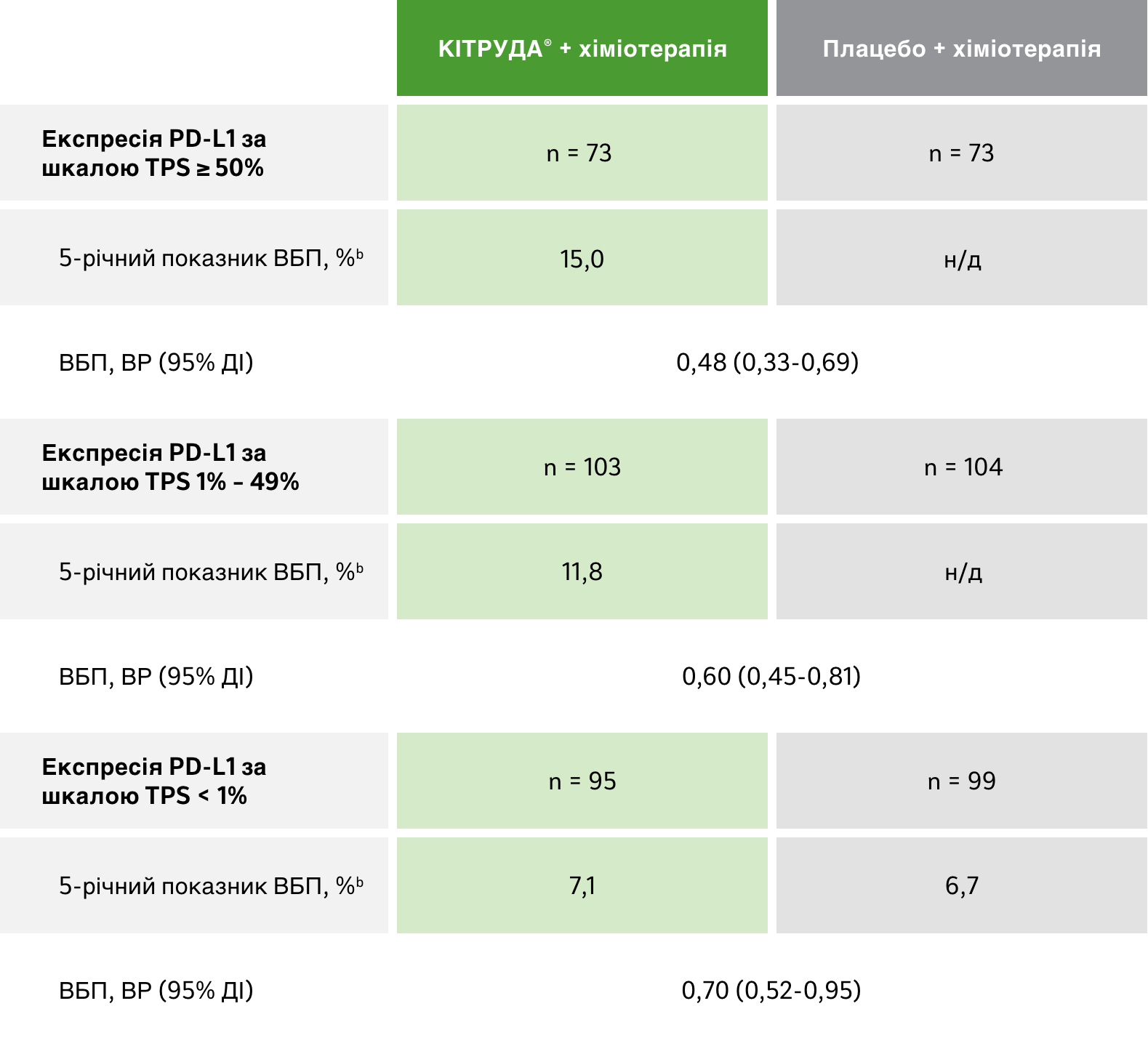
a За результатами BICR за критеріями RECIST версії 1.1.
b Оцінка Каплана-Майєра. Дата зрізу даних: 23 лютого 2022 року.1
карбо + пак/наб-пак = карбоплатин + паклітаксел або наб-паклітаксел; ДІ = довірчий інтервал; ВР = відношення ризиків; мНДКРЛ = метастатичний недрібноклітинний рак (карцинома) легень; н/д = не досягнуто; ЗЧВ = загальна частота відповіді на лікування; ЗВ = загальна виживаність; PD-L1 = ліганд програмованої смерті клітин 1 типу; ВБП = виживаність без прогресування захворювання
Список літератури:
1. Novello S, Kowalski DM, Luft A, et al. Pembrolizumab plus chemotherapy in squamous non-small-cell lung cancer: 5-year update of the Phase III KEYNOTE-407 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01990
Приблизно 3/5 пацієнтів відповіли на лікування препаратом КІТРУДА® + карбо + пак/наб-пак у порівнянні із приблизно 2/5 при застосуванні лише карбо + пак/наб-пак1,a,c
Медіана тривалості спостереження: 56,9 місяця
LIMITATION: Оновлений post-hoc аналіз (медіана тривалості спостереження: 56,9 місяцяa) у рамках дослідження KEYNOTE-407 був пошуковим за своїм характером і був виконаний після виконання проміжного аналізу (медіана тривалості спостереження: 7,8 місяцяb). Ніякого формального статистичного тестування для цього оновленого аналізу заплановано не було, тому не можуть бути зроблені ніякі статистичні висновки. Учасники дослідження в обох досліджуваних групах могли отримувати подальшу протипухлинну терапію.1
У загальній популяції пацієнтів:
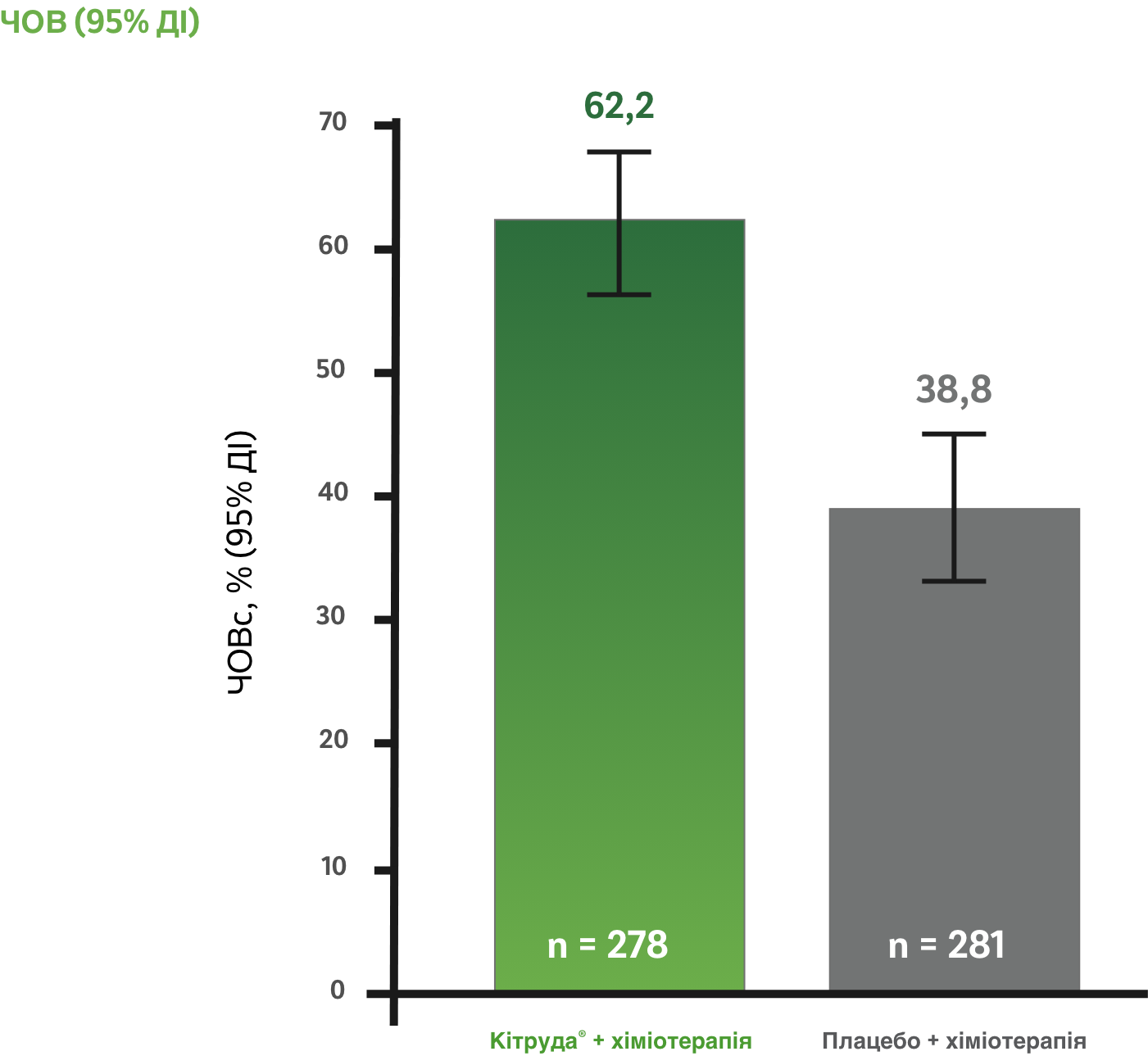
a Час від рандомізації до дати зрізу даних.1
b Час від рандомізації до смерті або до дати зрізу даних для тих пацієнтів, які залишалися живими.1
c За результатами BICR за критеріями RECIST версії 1.1.1
карбо + пак/наб-пак = карбоплатин + паклітаксел або наб-паклітаксел
Список літератури:
1. Novello S, Kowalski DM, Luft A, et al. Pembrolizumab plus chemotherapy in squamous non-small-cell lung cancer: 5-year update of the Phase III KEYNOTE-407 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01990
Приблизно 3/5 пацієнтів відповіли на лікування препаратом КІТРУДА® + карбо + пак/наб-пак у порівнянні із приблизно 2/5 при застосуванні лише карбо + пак/наб-пак1,a,c
Медіана тривалості спостереження: 56,9 місяця
ОБМЕЖЕННЯ: Оновлений post-hoc аналіз (медіана тривалості спостереження: 56,9 місяцяa) у рамках дослідження KEYNOTE-407 був пошуковим за своїм характером і був виконаний після виконання проміжного аналізу (медіана тривалості спостереження: 7,8 місяцяb). Ніякого формального статистичного тестування для цього оновленого аналізу заплановано не було, тому не можуть бути зроблені ніякі статистичні висновки. Учасники дослідження в обох досліджуваних групах могли отримувати подальшу протипухлинну терапію.1
У загальній популяції пацієнтів: медіана ТВЛ на час виконання оновленого аналізу1,d
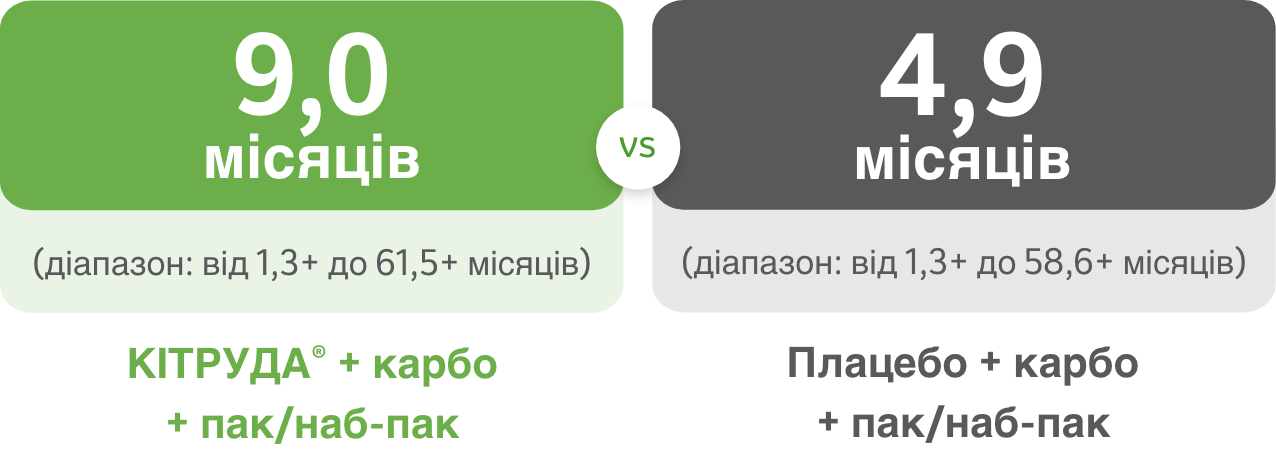
a Час від рандомізації до дати зрізу даних.1
b Час від рандомізації до смерті або до дати зрізу даних для тих пацієнтів, які залишалися живими.1
c Оцінка Каплана-Мейєра. Дата зрізу даних: 23 лютого 2022 року.1
Список літератури:
1. Novello S, Kowalski DM, Luft A, et al. Pembrolizumab plus chemotherapy in squamous non-small-cell lung cancer: 5-year update of the Phase III KEYNOTE-407 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01990
Популяція для оцінки безпечності: Усі пацієнти, які отримували лікування1
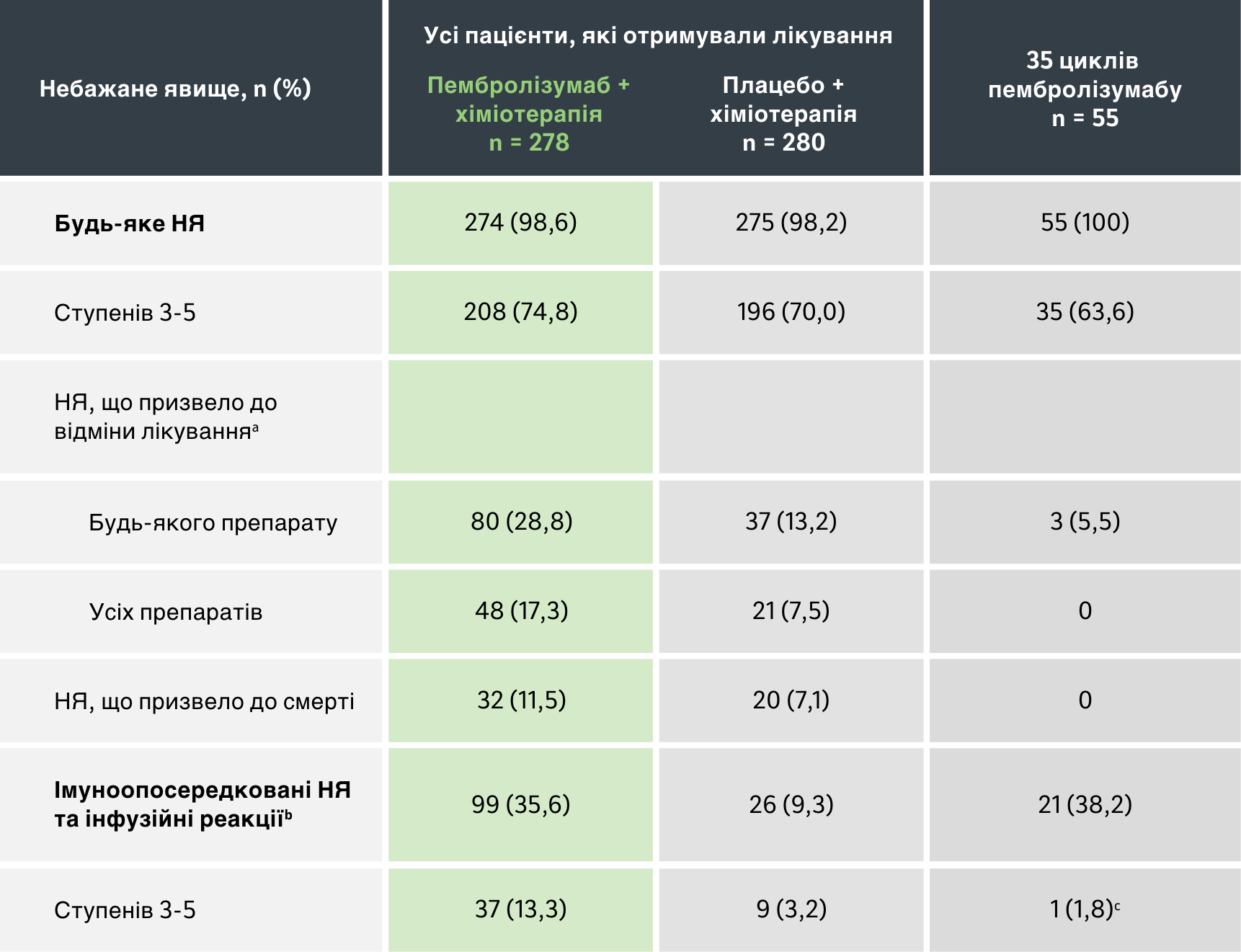
a Ця категорія включає пацієнтів, у яких було припинене застосування пембролізумабу або плацебо, карбоплатину і таксану через НЯ у будь-який момент часу, і пацієнтів, у яких було припинене застосування пембролізумабу або плацебо через НЯ після проходження чотирьох 3-тижневих циклів карбоплатину і таксану.
b Події враховуються незалежно від того, чи дослідник розцінює їх пов’язаними з лікуванням або імуноопосередкованими.
c Серед пацієнтів, які пройшли 35 циклів терапії пембролізумабом, було відмічено 1 подію 3 ступеня важкості – коліт; не відмічалося жодних імуноопосередкованих НЯ або інфузійних реакцій 4 або 5 ступеня важкості.
Дата зрізу даних: 23 лютого 2022 року.
Список літератури:
1. Novello S, Kowalski DM, Luft A, et al. Pembrolizumab plus chemotherapy in squamous non-small-cell lung cancer: 5-year update of the Phase III KEYNOTE-407 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01990
Список літератури
- Novello S, Kowalski DM, Luft A, et al. Pembrolizumab plus chemotherapy in squamous non-small-cell lung cancer: 5-year update of the Phase III KEYNOTE-407 study. J Clin Oncol. 2023. doi:10.1200/JCO.22.01990
UA-KEY-00352 | Дата затвердження: 08.2023 | Матеріал дійсний до: 07.2025