Дослідження KN-564: Монотерапія для ад’ювантного лікування НКК

Вступ

Препарат Kітруда® показаний для ад’ювантної терапії пацієнтів з НKK із помірно високим або високим ризиком рецидиву після нефректомії або після нефректомії та резекції метастатичних уражень1
Механізм дії
KІТРУДА: Блокада рецепторів PD-12
KІТРУДА не є хіміотерапією або променевою терапією – це імунотерапевтичний засіб.
Препарат KІТРУДА зв’язується з рецептором PD-1, блокуючи взаємодію обох імуносупресорних лігандів, PD-L1 і PD-L2, з PD-1, що допомагає відновити реактивність Т-клітин та імунну відповідь.
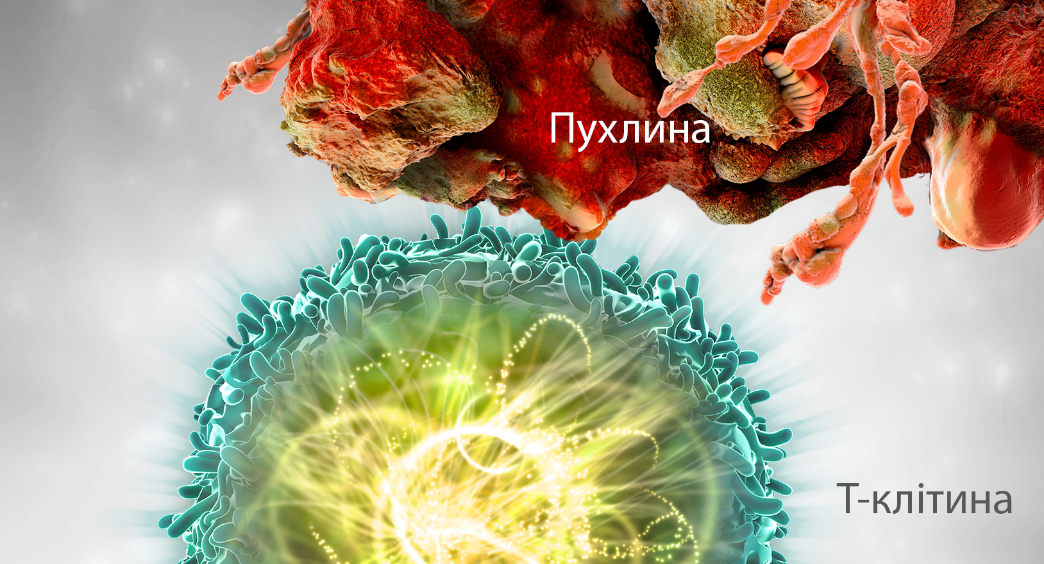
НОРМАЛЬНА ІМУННА ВІДПОВІДЬ
При нормальному функціонуванні Т-клітини активуються і можуть атакувати пухлинні клітини або антигенпрезентуючі клітини.
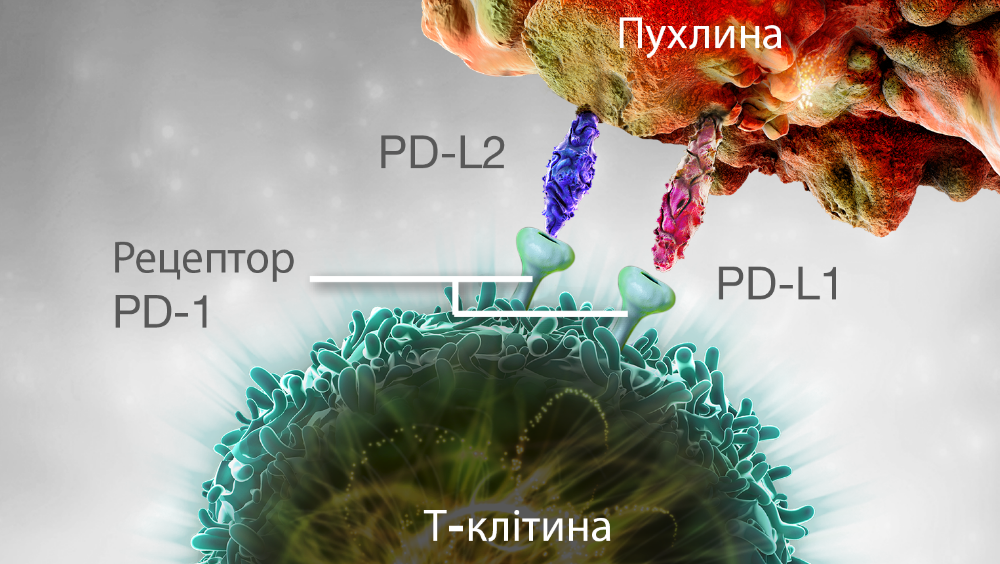
УНИKНЕННЯ МЕХАНІЗМІВ ІМУННОГО ЗАХИСТУ ПУХЛИНОЮ І ДЕАKТИВАЦІЯ Т-KЛІТИН
Деякі пухлини можуть уникати захисних механізмів імунної системи через PD-1 шлях. Ліганди PD-L1 і PD-L2 на пухлинних клітинах можуть зв’язуватися з рецепторами PD-1 на Т-клітинах, що призводить до інактивації Т-клітин.
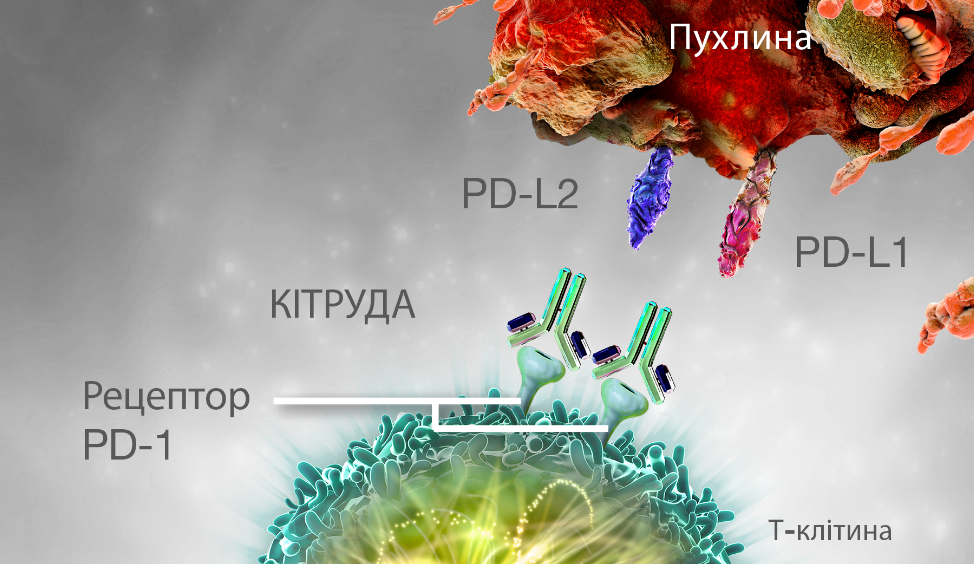
РЕАKТИВАЦІЯ Т-KЛІТИН ПРЕПАРАТОМ KІТРУДА
Препарат KІТРУДА зв’язується з рецептором PD-1 і блокує його взаємодію з PD-L1 і PD-L2, що допомагає відновити імунну відповідь. Впливаючи на пухлину, це також може обумовлювати вплив на неуражені здорові клітини.
НKK = нирково-клітинна карцинома; NCCN = Національна загальна мережа онкологічних закладів США® (NCCN®); PD-1 = рецептор програмованої смерті клітин 1 типу; PD-L1 = ліганд програмованої смерті клітин 1 типу; PD-L2 = ліганд програмованої смерті клітин 2 типу; M0 = відсутність віддалених метастазів; N0 = відсутність ураження регіональних лімфовузлів; N+ = метастази в регіональні лімфовузли; SEER = програма спостереження, збору епідеміологічних даних і клінічних наслідків; T = первинна пухлина; T2 = пухлина розміром > 7 см за найбільшим виміром, обмежена ниркою; T3 = пухлина поширюється у великі вени або перинефральні тканини, але не в іпсілатеральну (на боці ураженої нирки) надниркову залозу і не за межі фасції Героти; T4 = пухлина поширюється за межі фасції Героти (в тому числі з безпосереднім переходом на іпсілатеральну надниркову залозу).
References:
- Інструкція для медичного застосування лікарського засобу Kітруда. РП No UA/16209/01/01
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12(4):252-264
Дизайн дослідження
Багатоцентрове, рандомізоване, подвійне сліпе, плацебо-контрольоване дослідження 3 фази1
Рандомізоване, подвійно сліпе, плацебо-контрольоване дослідження 3 фази KEYNOTE-564 було сплановане з метою оцінки ад’ювантної монотерапії пембролізумабом у порівнянні з плацебо після виконаної нефректомії в учасників з локалізованою нирково-клітинною карциномою або після виконаної нефректомії і метастазектомії в учасників з нирково-клітинною карциномою стадії M1.
Kритерії включення пацієнтів у дослідження:1
- Дорослі особи віком 18 років або старше.
- Було виконане хірургічне втручання з приводу гістологічно підтвердженої нирково-клітинної карциноми зі світлоклітинним компонентом із саркоматоїдними ознаками або без них.
- Учасники були категоризовані як група помірно-високого ризику рецидиву захворювання (патологічна стадія пухлини 2 [pT2] з ядерним ступенем злоякісності 4 або саркоматоїдною диференціацією, відсутність ураження лімфовузлів [N0] і відсутність метастазів [M0]; або pT3, будь-який ступінь злоякісності, N0, M0), високого ризику рецидиву захворювання (pT4, будь-який ступінь злоякісності, N0, M0; або будь-яка стадія pT, будь- який ступінь злоякісності, N+, M0), або стадія M1 без ознак захворювання після повної резекції олігометастазів синхронно з нефректомією або у межах 1 року після нефректомії (M1 без ознак захворювання).
- Функціональний статус пацієнта за шкалою Східної об’єднаної онкологічної групи (ECOG) становить 0 балів або 1 бал.
- Було виконане хірургічне втручання у межах 12 тижнів до рандомізації.
- Мали вільний від проявів захворювання статус на вихідному рівні за оцінкою дослідника.
- Не отримували жодної попередньої системної терапії з приводу поширеної нирково-клітинної карциноми; і надали адекватні зразки тканин для оцінки на PD-L1 після нефректомії (якщо у них виконувалася лише нефректомія), після і нефректомії, і метастазектомії (якщо вони виконувалися синхронно) або після метастазектомії (якщо вона виконувалася після нефректомії; зразок тканини, отриманий після нефректомії, також мав бути наданий, якщо він доступний).
Kритерії виключення пацієнтів:1
- Якщо у них виконувалося яке-небудь серйозне хірургічне втручання, окрім нефректомії або метастазектомії, у межах 12 тижнів до рандомізації.
- Отримували попередню променеву терапію з приводу нирково-клітинної карциноми.
- Отримували попередню терапію анти-PD-1, анти-PD-L1, анти-PD-L2 препаратами або іншими коінгібіторами рецепторів Т-клітин.
- Мали вже існуючі метастази в головний мозок або в кістки.
- Учасники з залишковим захворюванням після нефректомії.
Фактори стратифікації:1
- Статус за наявністю метастазів (M0 або M1 NED).
- Додаткова стратифікація у межах підгрупи «Без метастазів» (M0) за функціональним статусом за шкалою ECOG (в діапазоні 0-5 балів, де більша кількість балів означає більшу недієздатність).
- Географічний регіон (США або не-США)

- Основний показник ефективності: Виживаність без проявів захворювання (ВБЗ) за оцінкою дослідника.1
- Ключовий другорядний показник клінічних наслідків: загальна виживаність (ЗВ).1
- Медіана тривалості спостереження: 30,1 місяця (діапазон: 20,8-47,5 місяця).1
Вихідні характеристики
Помірно-високий ризик:2
pT2 із ступенем злоякісності 4 або саркоматоїдними ознаками
pT3 з будь-яким ступенем злоякісності без ураження лімфовузлів (N0) або віддалених метастазів (M0)
Високий ризик:2

pT4, з будь-яким ступенем злоякісності, N0 і M0

Будь-яка стадія pT, будь-який ступінь злоякісності з ураженням лімфовузлів (N+) і M0
M1 NED:2
Пацієнти з метастатичним захворюванням, у яких була виконана повна резекція первинної пухлини і метастатичних вогнищ
ФС за шкалою ECOG = функціональний статус за шкалою Східної об’єднаної онкологічної групи; M0 = відсутність метастазів; M1 = метастази у віддаленому органі або тканині; NED = відсутність ознак захворювання; 1 р/3 т = кожні 3 тижні; НKK = нирково-клітинна карцинома.
References:
- Powles T, Tomczak P, Park SH, et al. Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for clear cell renal cell carcinoma (KEYNOTE-564): 30-month follow-up analysis of a multicentre, randomised, doubleblind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022;23(9):1133-1144. doi:10.1016/S1470-2045(22)00487- 9
- Choueiri TK, Tomczak P, Park SH, et al. Adjuvant pembrolizumab after nephrectomy in renal-cell carcinoma. N Engl J Med. 2021;385(8):683–69.
Виживаність без ознак захворювання
Лікування препаратом KІТРУДА статистично значущо знижувало ризик рецидиву захворювання або смерті на 32% у порівнянні з плацебо1
Медіана часу від рандомізації до дати зрізу даних: 24,1 місяця (діапазон: 14,9 – 41,5 місяця)1
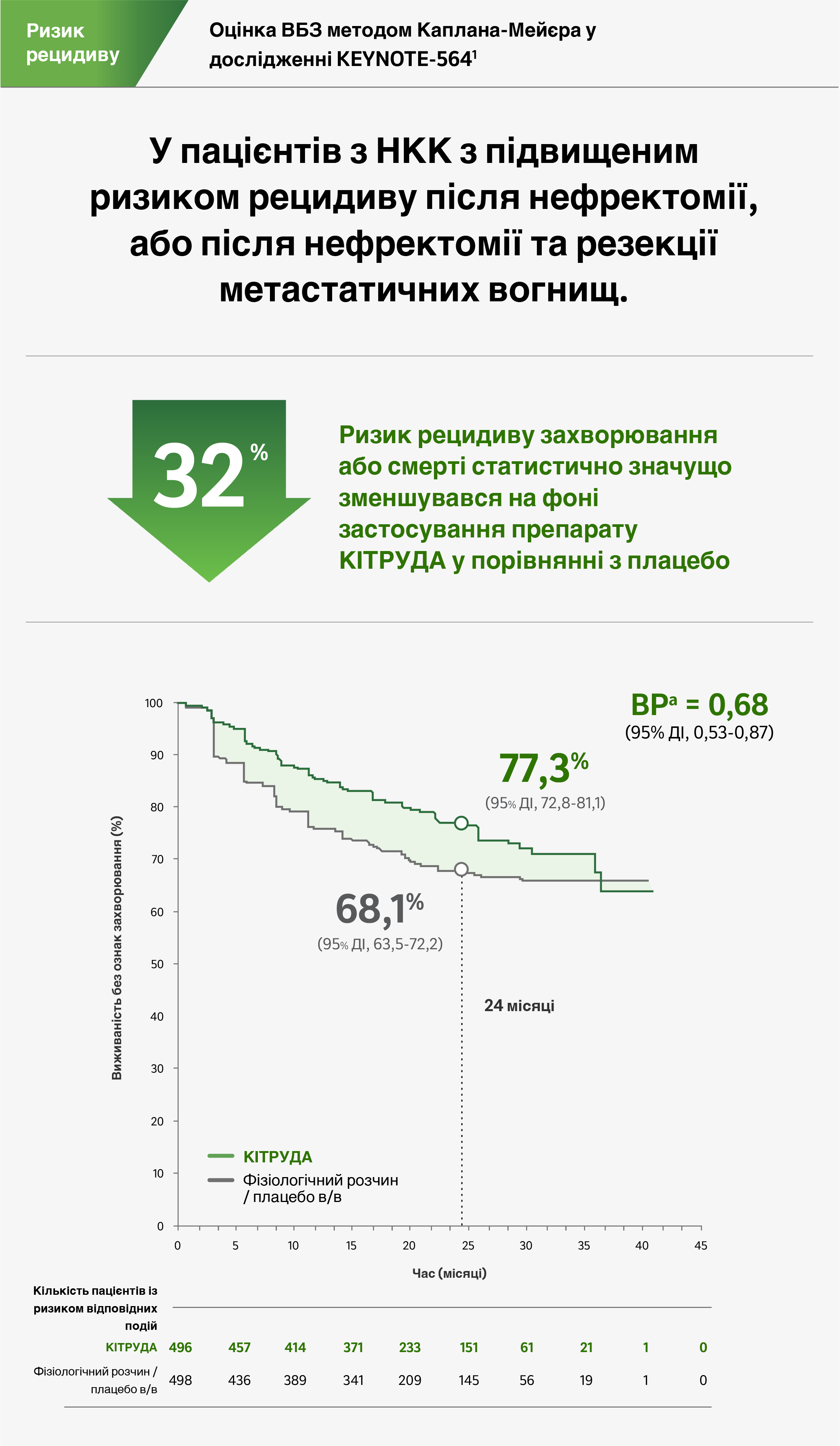
a Визначено з використанням стратифікованої моделі пропорційних ризиків Кокса.1
b Визначено з використанням стратифікованого лог-рангового тесту.1
c Граничний рівень для P-значення, що є критерієм статистичної значущості, дорівнює 0,0114 (односторонній) для аналізу виживаності без ознак захворювання.1
- Спостережувані явища: 109/496 (22%) при застосуванні препарату KІТРУДА у порівнянні з 151/498 (30%) при застосуванні плацебо.
- Медіана ВБЗ: Не досягнута для препарату KІТРУДА або для плацебо.
- На час виконання аналізу ВБЗ дані щодо ЗВ ще не були остаточними.
Аналіз за даними подальшого спостереження: медіана 30,1 місяця2
Обмеження: Жодного формального статистичного тестування для цього оновленого аналізу заплановано не було, тому не можуть бути зроблені жодні висновки.2
Медіана часу від рандомізації до дати зрізу даних: 30,1 місяця (діапазон: 25,7-36,7 місяця)2
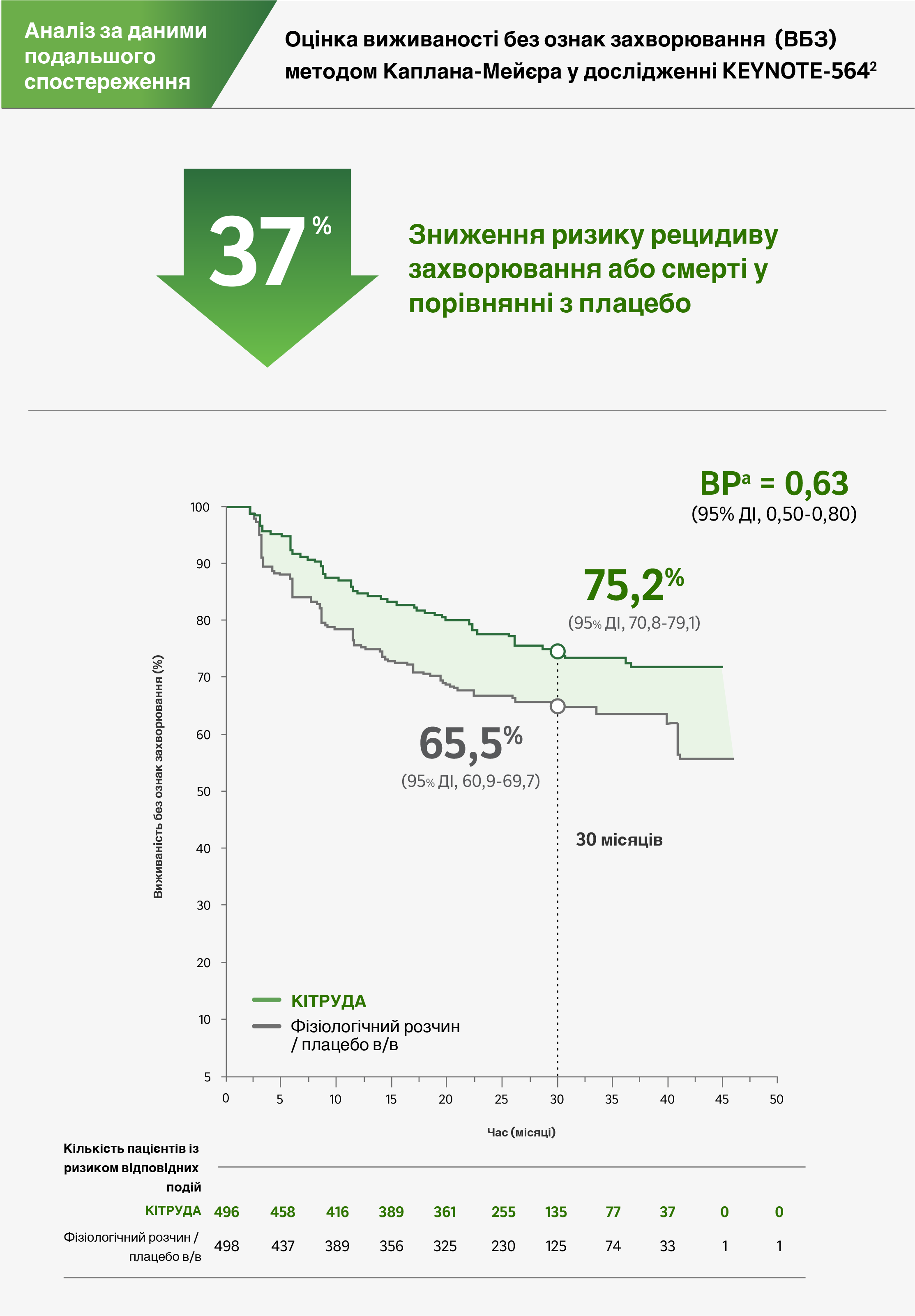
ВР = відношення ризиків; ДІ = довірчий інтервал.
References:
- Choueiri TK, Tomczak P, Park SH, et al. Adjuvant pembrolizumab after nephrectomy in renal-cell carcinoma. N Engl J Med. 2021;385(8):683–694.
- Powles T, Tomczak P, Park SH, et al. Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for clear cell renal cell carcinoma (KEYNOTE-564): 30-month follow-up analysis of a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022;23(9):1133-1144. doi:10.1016/S1470-2045(22)00487-9
Профіль безпечності
Небажані явища, що виникли з будь-якої причини, з частотою мінімум 10% у будь-якій групі (популяція пацієнтів «згідно з призначеним лікуванням»).1

* Не спостерігалося жодних небажаних явищ ступеня 4 або 5 у мінімум 10% пацієнтів у будь-якій групі.
Адаптовано з Таблиці 3 зі статті Choueiri TK, Tomczak P, Park SH, et al. N Engl J Med. 2021;385(8):683–69
Небажані реакції:1
- У популяції пацієнтів «згідно з призначеним лікуванням» 20,7% пацієнтів у групі застосування пембролізумабу і 2,0% пацієнтів у групі застосування плацебо достроково припинили відповідне досліджуване лікування через небажані явища, більшість із яких були несерйозними.
- Серед пацієнтів, які отримували пембролізумаб, до дострокового припинення лікування у 1,0% або більше пацієнтів призводили лише збільшення рівня аланінамінотрансферази (у 1,6%), недостатність надниркових залоз (у 1,0%) і коліт (у 1,0%). Тимчасове призупинення прийому препарату через небажані явища було зареєстроване у 25,8% пацієнтів у групі застосування пембролізумабу і у 14,9% пацієнтів у групі застосування плацебо.
- Принаймні одне серйозне небажане явище, пов’язане з лікуванням, виникло у 12,1% пацієнтів, які отримували пембролізумаб, і у 0,2% пацієнтів, які отримували плацебо.
- Найбільш частими небажаними явищами, що виникли з будь-якої причини, у двох групах пацієнтів були підвищена втомлюваність (у 29,7% пацієнтів, які отримували пембролізумаб, і у 24,2% пацієнтів, які отримували фізіологічний розчин / плацебо в/в), діарея (у 25,4% і 22,4% відповідно), свербіння (у 22,7% і 13,1%) і артралгія (у 22,1% і 18,8%).
- Медіана тривалості досліджуваного лікування становила 11,1 місяця (діапазон: 0,0-14,3) у групі застосування пембролізумабу і 11,1 місяця (діапазон: 0,0-15,4) у групі застосування плацебо.
- Популяція пацієнтів «згідно з призначеним лікуванням» включала усіх пацієнтів, які отримали принаймні одну дозу пембролізумабу або плацебо. Небажані явища документувалися з часу рандомізації і до завершення 30 днів після припинення застосування пембролізумабу або плацебо. Серйозні небажані явища визначалися як будь-яке небажане явище, яке призвело до смерті, було небезпечним для життя, призвело до госпіталізації в стаціонар, призвело до стійкої або вираженої інвалідизації або недієздатності, було вродженою аномалією або вадою розвитку або було розцінене дослідником як серйозне небажане явище. Серйозні небажані явища документувалися з часу рандомізації і до завершення 90 днів після припинення застосування пембролізумабу або плацебо.
Kритерії відбору пацієнтів
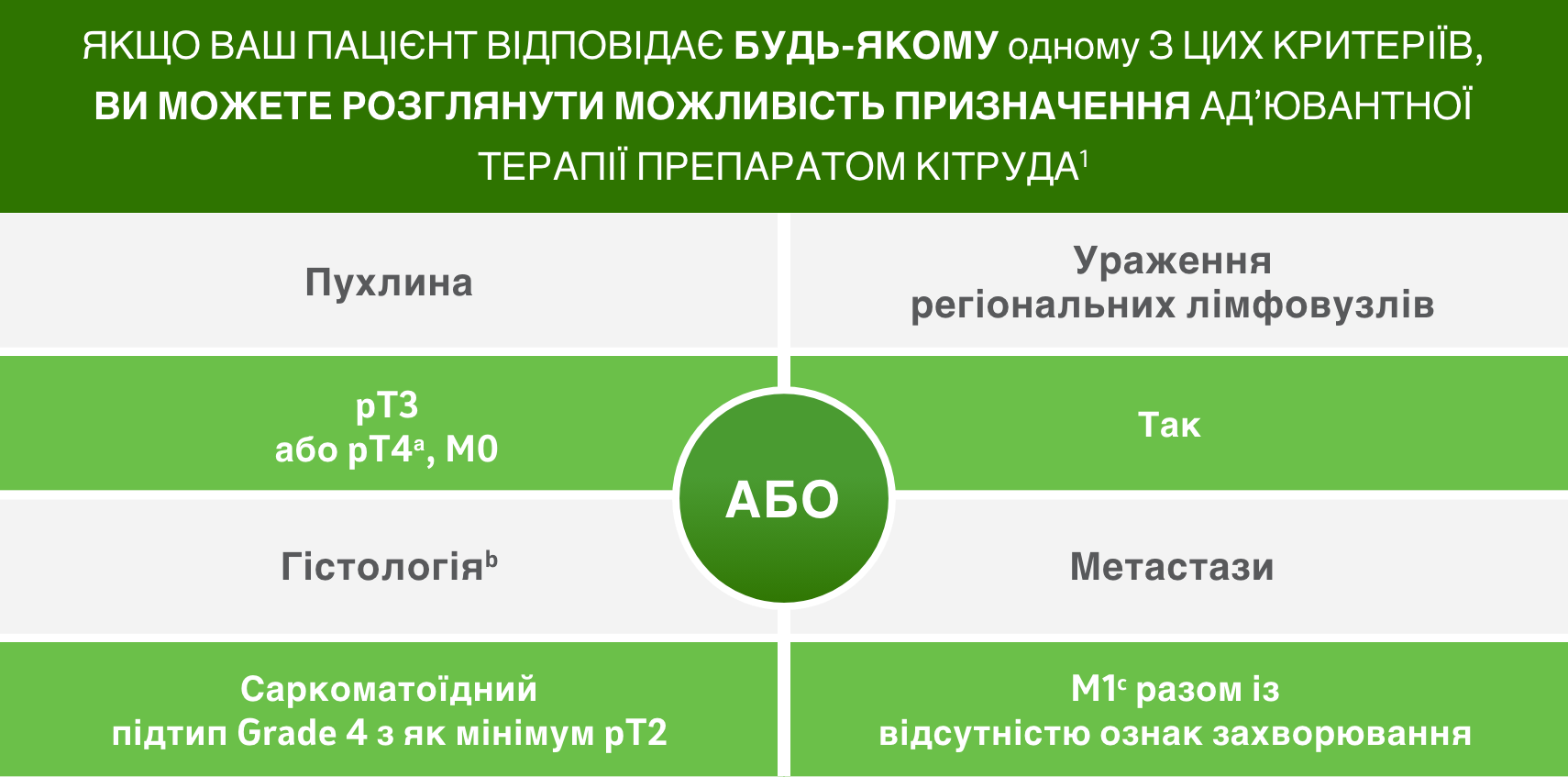
Адаптовано з Choueiri TK, et al.
a Повна резекція пухлини
b всі пацієнти в KN-564 дослідженні були із світлоклітинною карциномою
c метастазектомія з повною резекцією пухлини
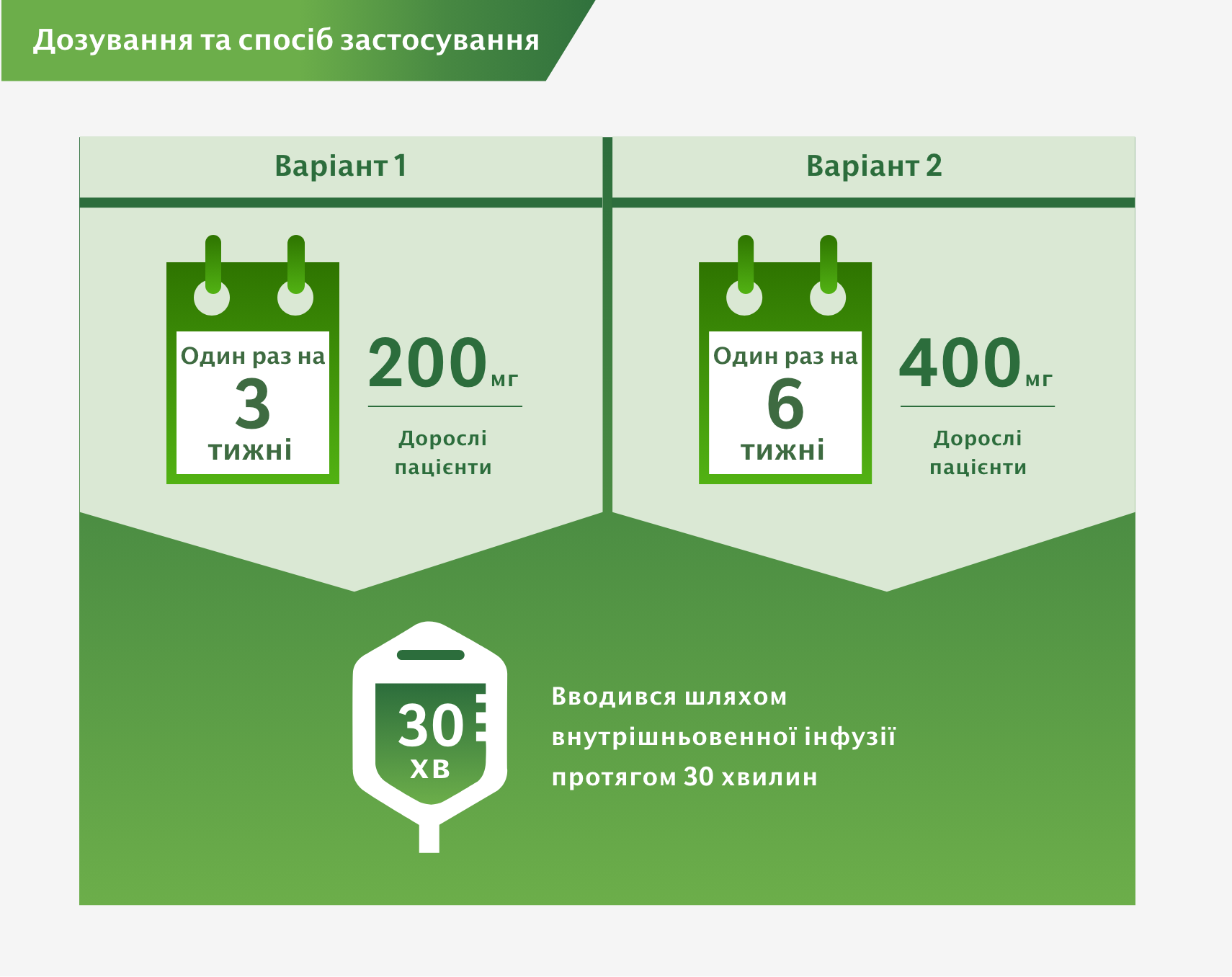
Дозування та спосіб застосування3
Пацієнти отримували 200 мг препарату KІТРУДА шляхом внутрішньовенної інфузії кожні 3 тижні або фізіологічний розчин / плацебо в/в до 1 року або до виникнення рецидиву захворювання чи неприйнятних проявів токсичності.
NCI-CTCAE = Загальні термінологічні критерії небажаних явищ Національного інституту раку; АЛТ = аланінамінотрансфераза.
References:
- Choueiri TK, Tomczak P, Park SH, et al; for the KEYNOTE-564 investigators. Adjuvant pembrolizumab after nephrectomy in renal-cell carcinoma. N Engl J Med. 2021;385(8):683–694.
- Powles T, Tomczak P, Park SH, et al. Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for clear cell renal cell carcinoma (KEYNOTE-564): 30-month follow-up analysis of a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022;23(9):1133-1144. doi:10.1016/S1470-2045(22)00487-9
- Інструкція для медичного застосування лікарського засобу Kітруда. РП No UA/16209/01/01