Дослідження KEYNOTE-522

-
Кінцеві точки
ефективності -
Дозування і спосіб
застосування -
Мультидисциплінарний
підхід -
Дизайн
дослідження - Портрет пацієнта
Вступ
Препарат КІТРУДА® показаний для лікування пацієнтів із ранніми стадіями тричі-негативного раку грудної залози (ТНРГЗ) групи високого ризику у комбінації з хіміотерапією3 як неоад’ювантне лікування, після чого препарат продовжують застосовувати у вигляді монотерапії як ад’ювантне лікування після хірургічного втручання.1

- Кількість пацієнтів з відповідними подіями становила 123/784 (15,7%) на фоні застосування препарату КІТРУДА® + хіміотерапіяa у порівнянні з 93/390 (23,8%) на фоні застосування плацебо + хіміотерапіяa (ВР = 0,63; 95% ДІ: 0,48-0,82; P = 0,00031; P < 0,001).2
- Розрахована загальна виживаність через 36 місяців становила 89,7% (95% ДІ: 87,3-91,7) у групі застосування пембролізумабу + хіміотерапія і 86,9% (95% ДІ: 83,0-89,9) у групі застосування плацебо + хіміотерапія; медіана загальної виживаності не була досягнута у жодній з груп.2
- Попередньо визначений, нерандомізований, пошуковий аналіз безподійної виживаностіb, виконаний відповідно до наявності (так або ні) патологічної повної відповідіc,d (ypT0–Tis ypN0), показав, що серед пацієнтів з патологічною повною відповіддю у 27 з 494 пацієнтів (5,5%) у групі застосування пембролізумабу + хіміотерапія і у 16 з 217 пацієнтів (7,4%) у групі застосування плацебо + хіміотерапія виникла відповідна подія або настала смерть (відношення ризиків: 0,73; 95% ДІ: 0,39-1,36).2
a а. Хіміотерапія: Карбоплатин і паклітаксел з наступним застосуванням (доксорубіцину або епірубіцину) і циклофосфаміду.
b Безподійна виживаність визначалася як час від рандомізації до першого виникнення будь-якої з наступних подій: прогресування захворювання, яке перешкоджає виконанню хірургічного втручання, місцевий або віддалений рецидив, друге первинне злоякісне захворювання або смерть з будь-якої причини.1
c пПВ визначалася як відсутність інвазивного раку в грудній залозі і лімфовузлах (ypT0/Tis ypN0) і оцінювалася місцевим патологом в сліпому режимі на час виконання радикального хірургічного втручання.1
d За результатами попередньо визначеного проміжного аналізу пПВ (у порівнянні з рівнем статистичної значущості 0,003).2
Незадоволена потреба
- Загалом деякі пацієнти з ТНРГЗ мали гірші клінічні наслідки через рецидивування захворювання, незважаючи на отримане ними початкове лікування.4
Кінцеві точки ефективності
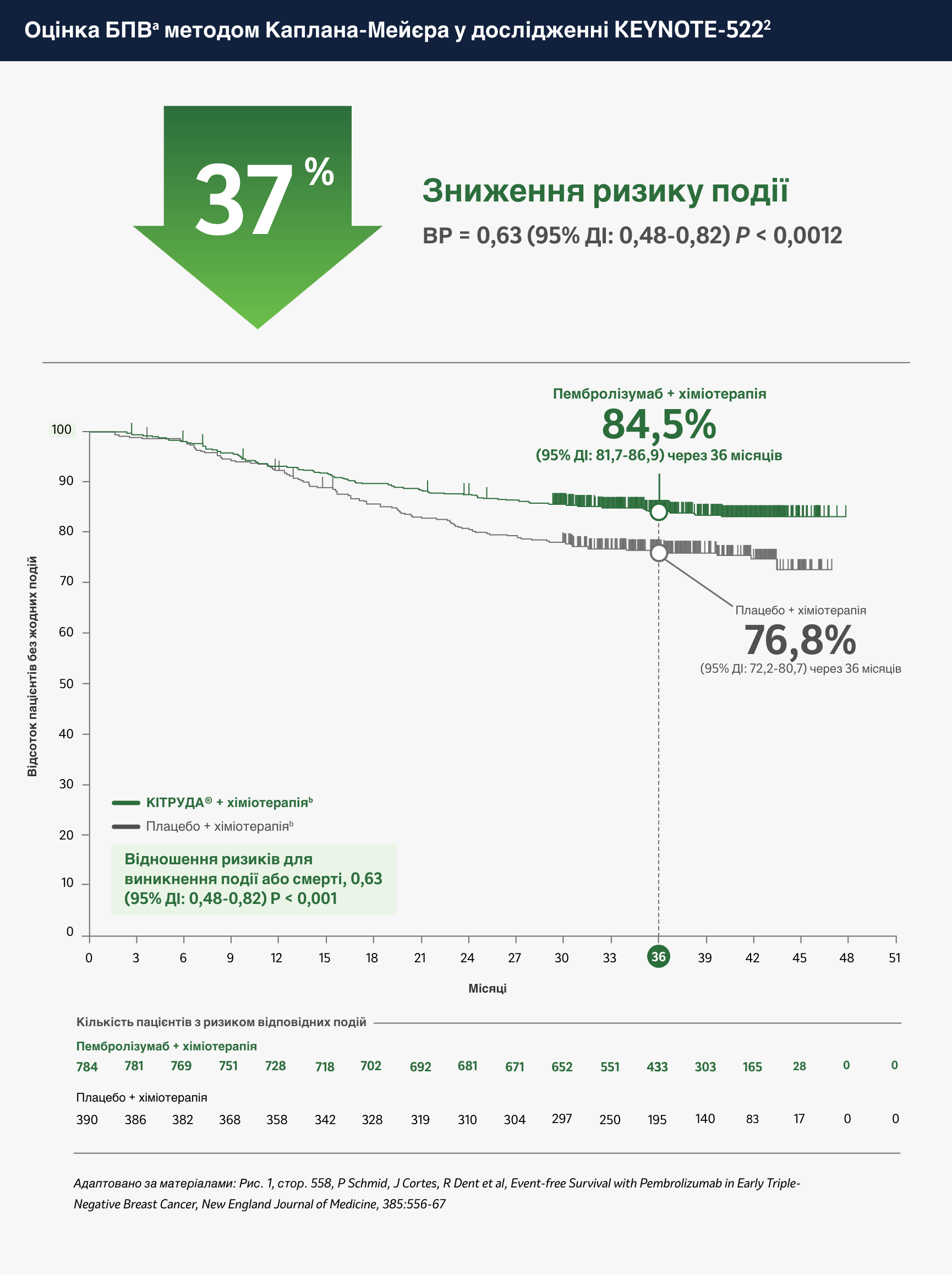
Кількість пацієнтів з відповідними подіями становила 123/784 (15,7%) на фоні застосування препарату КІТРУДА® + хіміотерапіяb у порівнянні з 93/390 (23,8%) на фоні застосування плацебо + хіміотерапіяb (ВР = 0,63; 95% ДІ: 0,48-0,82; P < 0,001).2
- За результатами четвертого запланованого проміжного аналізу (дата зрізу даних: 23 березня 2021 року) медіана тривалості спостереження становила 39,1 місяця (діапазон: 30,0-48,0).2
- Розрахована безподійна виживаність через 36 місяців становила 84,5% (95% ДІ: 81,7-86,9) у групі застосування пембролізумабу + хіміотерапія і 76,8% (95% ДІ: 72,2-80,7) у групі застосування плацебо + хіміотерапія; медіана безподійної виживаності не була досягнута у жодній з груп.2
- У пацієнтів з ранніми стадіями ТНРГЗ групи високого ризику неоад’ювантна терапія препаратом КІТРУДА® + хіміотерапіяb з наступною ад’ювантною терапією препаратом КІТРУДА® після хірургічного втручання забезпечили статистично значущо довшу безподійну виживаність у порівнянні з неоад’ювантною терапією плацебо + хіміотерапіяb з наступним застосуванням плацебо після хірургічного втручання.2
a За результатами попередньо визначеного проміжного аналізу БПВ (у порівнянні з рівнем статистичної значущості 0,0052).1
b Хіміотерапія: Карбоплатин і паклітаксел з наступним застосуванням (доксорубіцину або епірубіцину) і циклофосфаміду.2
c На основі регресійної моделі Кокса з методом Ефрона для обробки співпадінь з використанням лікування як коваріати зі стратифікацією за наявністю ураження лімфовузлів, за розміром пухлини і за обраною схемою введення карбоплатину.2
d На основі лог-рангового тесту зі стратифікацією за наявністю ураження лімфовузлів, за розміром пухлини і за обраною схемою введення карбоплатину.2
P Schmid, J Cortes, R Dent et al, Event-free Survival with Pembrolizumab in Early Triple-Negative Breast Cancer, New England Journal of Medicine, 385:556-67, Copyright © 2022, Massachusetts Medical Society. Передруковано з дозволу Массачусетського медичного товариства.
Статистично значуще покращення частоти пПВa на фоні застосування препарату КІТРУДА® + хіміотерапіяb у порівнянні з плацебо + хіміотерапіяb на час виконання радикального хірургічного втручання у дослідженні KEYNOTE-5223
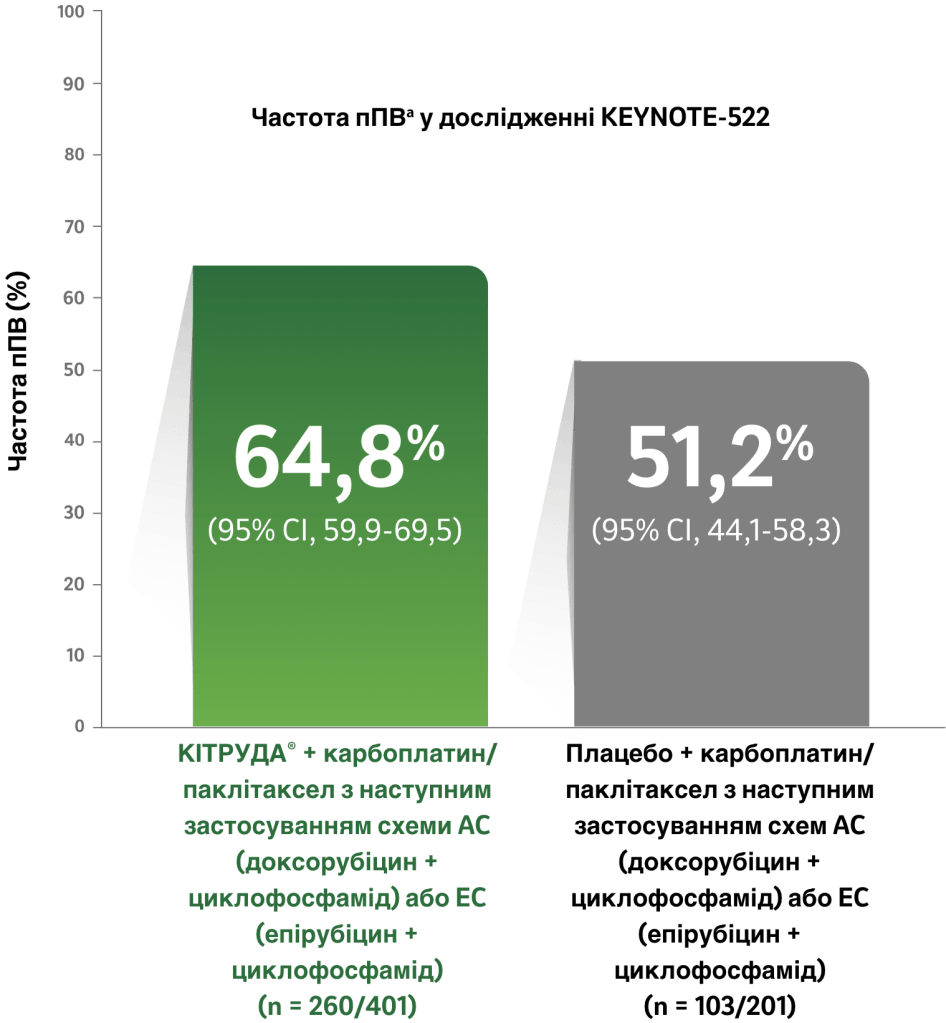
- На 13,6% більше пацієнтівc досягли пПВa на фоні застосування схеми препарат КІТРУДА® + хіміотерапіяb у порівнянні зі схемою плацебо + хіміотерапіяb (95% ДІ: 5,4-21,8; P < 0,001).3
- У четвертому запланованому проміжному аналізі (дата зрізу даних: 23 березня 2021 року) медіана тривалості спостереження становила 39,1 місяця (діапазон: 30,0-48,0).3
a За результатами попередньо визначеного проміжного аналізу пПВ (у порівнянні з рівнем статистичної значущості 0,003).3
bХіміотерапія: Карбоплатин і паклітаксел з наступним застосуванням (доксорубіцину або епірубіцину) і циклофосфаміду.3
c На основі методу Міттінена і Нурмінена зі стратифікацією за наявністю ураження лімфовузлів, за розміром пухлини і за обраною схемою введення карбоплатину.3
Умовні скорочення:
AC = схема «доксорубіцин + циклофосфамід»; EC = схема «епірубіцин + циклофосфамід».
Список літератури:
- Інструкція для медичного застосування лікарського засобу Кітруда. PП UA/16209/01/01
- Schmid P, Cortes J, Dent R, et al. Event-free survival with pembrolizumab in early triple negative breast cancer. N Engl J Med. 2022;386(6):556–567. doi:10.1056/nejmoa2112651.
- Schmid P, Cortes J, Pusztai L, et al. Pembrolizumab for early triple-negative breast cancer. N Engl J Med. 2020;382(9):810–821. doi:10.1056/nejmoa1910549
- Gupta GK, Collier AL, Lee D, et al. Perspectives on triple-negative breast cancer: current treatment strategies, unmet needs, and potential targets for future therapies. Cancers (Basel). 2020;12(9):2392. doi:10.3390/cancers12092392
Дозування Та Спосіб Застосування
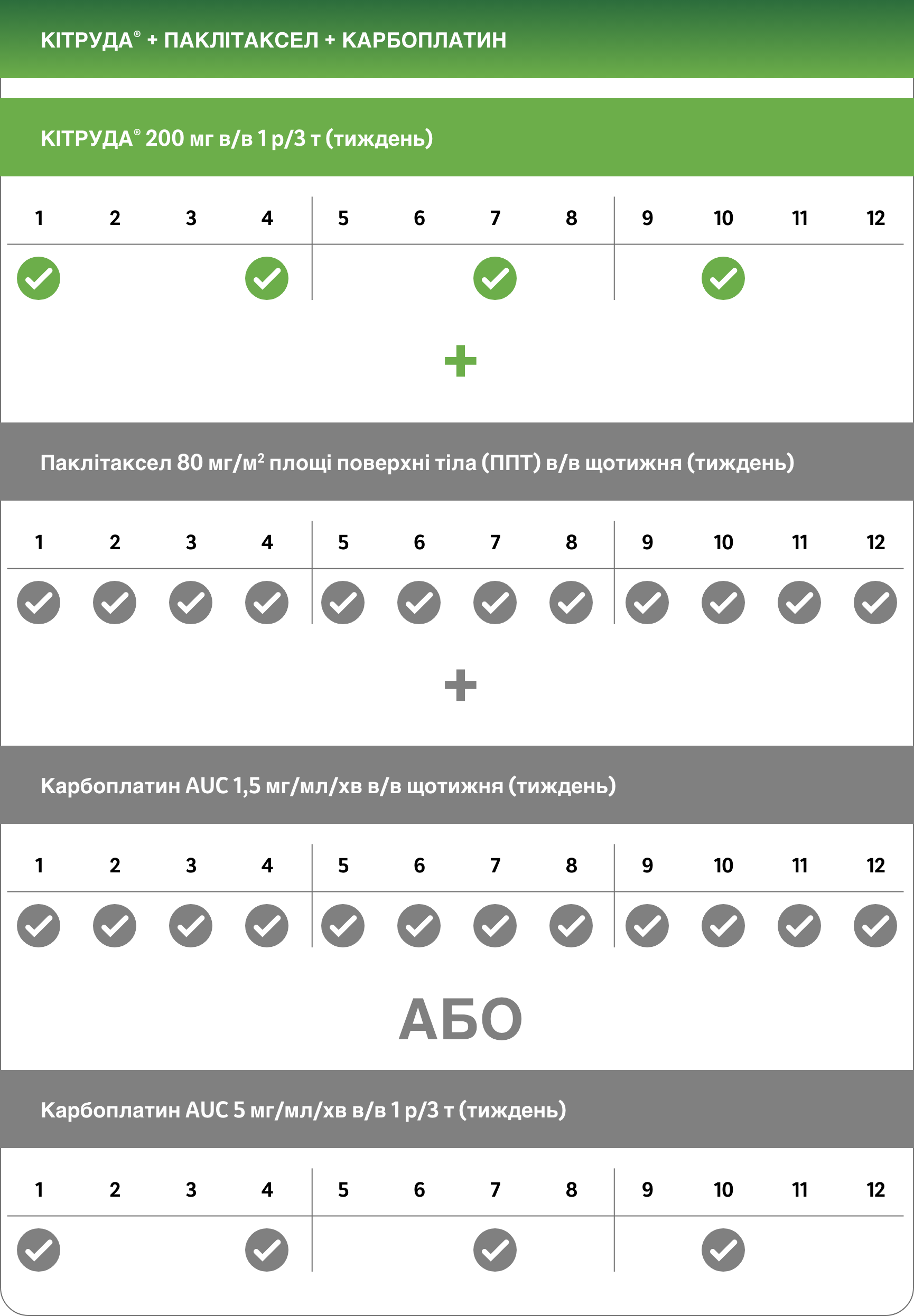
Неоад’ювантна терапія (Цикли 1-4)1
Неоад’ювантна терапія (Цикли 5-8)1
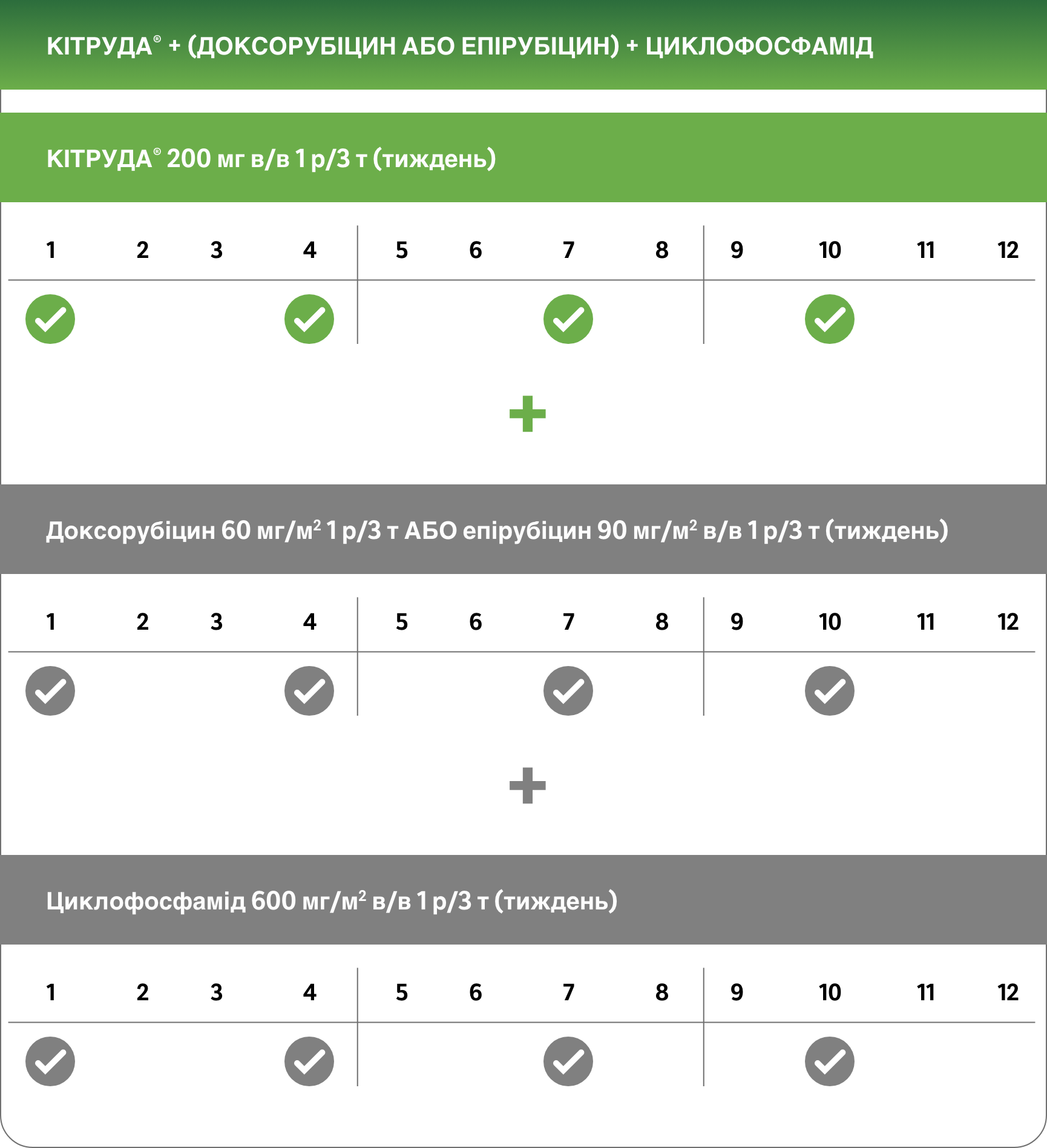
Хірургія
Ад’ювантна терапія (після хірургічного втручання, 9 циклів)1

Рекомендована доза препарату КІТРУДА® у дорослих осіб становить або 200 мг 1 р/3 т, або 400 мг 1 р/6 т2
Препарат КІТРУДА® вводиться шляхом внутрішньовенної інфузії протягом 30 хвилин. При призначенні препарату КІТРУДА® у комбінації з внутрішньовенною хіміотерапією препарат КІТРУДА® необхідно вводити першим. Для неоад’ювантної і ад’ювантної терапії у пацієнтів із ранніми стадіями ТНРГЗ високого ризику необхідно призначати препарат КІТРУДА® у комбінації з хіміотерапієюa як неоад’ювантне лікування у кількості 8 доз по 200 мг кожні 3 тижні або 4 дози по 400 мг кожні 6 тижнів або поки не виникне прогресування захворювання, яке перешкоджає виконанню радикального хірургічного втручання, або прояви неприйнятної токсичності, з наступним ад’ювантним лікуванням препаратом КІТРУДА® у вигляді монотерапії у кількості 9 доз по 200 мг кожні 3 тижні або 5 доз по 400 мг кожні 6 тижнів або поки не виникне рецидивування захворювання або прояви неприйнятної токсичності. Пацієнтам, у яких виникло прогресування захворювання, яке перешкоджає виконанню радикального хірургічного втручання, або прояви неприйнятної токсичності, пов’язані із застосуванням препарату КІТРУДА® як неоад’ювантної терапії у комбінації з хіміотерапієюa, не слід призначати препарат КІТРУДА® як монотерапію для ад’ювантної терапії.
Знижувати дозу препарату КІТРУДА® не рекомендується. Для контролю середньоважких і важких небажаних реакцій необхідно призупинити або відмінити препарат КІТРУДА® згідно з рекомендаціями, наведеними в маркуванні продукту.
Умовні скорочення:
в/в = внутрішньовенний; 1 р/3 т = 1 раз на 3 тижні; AUC = площа під кривою; 1 р/6 т = 1 раз на 6 тижнів.
Список літератури:
- Schmid P, Cortes J, Dent R, et al. Event-free survival with pembrolizumab in early triple negative breast cancer. N Engl J Med. 2022;386(6):556–567. doi:10.1056/nejmoa2112651.
- Інструкція для медичного застосування лікарського засобу Кітруда. PП UA/16209/01/01
Мультидисциплінарний підхід
Обирайте мультидисциплінарний підхід для Ваших пацієнтів з ранніми стадіями ТНРГЗ групи високого ризику, які відповідають належним вимогам, що включає неоад’ювантну терапію препаратом КІТРУДА® + хіміотерапіяa з наступним хірургічним втручанням і потім ад’ювантною монотерапією препаратом КІТРУДА®.

- У дослідженні KEYNOTE-522 використовувалися такі підходи до лікування, як хіміотерапія,a імунотерапія і хірургічні втручання.1
- Лікування препаратом КІТРУДА® + хіміотерапіяa є комбінованою схемою терапії антитілами до PD-1, що показана пацієнтам з ранніми стадіями ТНРГЗ групи високого ризику.1,2,3,4
- Препарат КІТРУДА® і хіміотерапіяa мають два незалежні механізми дії; у той час як препарат КІТРУДА® допомагає реактивувати імунні механізми протипухлинного захисту, хіміотерапіяa обумовлює цитотоксичну дію безпосередньо на пухлинні клітини.1,5
a Хіміотерапія: Карбоплатин і паклітаксел з наступним застосуванням (доксорубіцину або епірубіцину) і циклофосфаміду.
References:
- Інструкція для медичного застосування лікарського засобу Кітруда. PП UA/16209/01/01
- Opdivo SMPC
- Libtayo SMPC
- Jemperli SMPC
- National Cancer Institute. Chemotherapy. Dictionary of Cancer Terms. Accessed August 1, 2023. https://www.cancer.gov/publications/dictionaries/cancer-terms/def/chemotherapy
Дизайн Дослідження
Рандомізоване, багатоцентрове, подвійне сліпе, плацебо-контрольоване дослідження, яке проводилося за участі 1174 пацієнтів з вперше діагностованим ТНРГЗ на ранній стадії групи високого ризику, з приводу якого вони раніше не отримували лікування.1
Основні критерії включення пацієнтів у дослідження1
- Вік принаймні 18 років
- Вперше діагностований, централізовано підтверджений, неметастатичний (M0) ТНРГЗa
- Раніше нелікований місцевопоширений неметастатичний (M0) ТНРМЗ, що визначається наступними критеріями стадіювання за статусом первинної пухлини і ураження регіональних лімфовузлів (N)
T1c, N1-N2
T2, N0-N2
T3, N0-N2
T4a-d, N0-N2
Допускаються двосторонні або багатовогнищеві первинні пухлини і запальні форми раку молочної залози - Функціональний статус за шкалою ECOG на рівні 0-1 балу
- Задовільна функція внутрішніх органів
Основні критерії виключення пацієнтів із дослідження1
- Активне аутоімунне захворювання, з приводу якого пацієнт отримував системну терапію у межах попередніх 2 років
- Діагностований імунодефіцит або використання імуносупресивної терапії у межах попереднього тижня
- Наявність в анамнезі інфекції вірусу імунодефіциту людини
- Наявність в анамнезі неінфекційного пневмоніту, з приводу якого пацієнт отримував глюкокортикоїди, наявність у даний час пневмоніту, активного туберкульозу, активної інфекції вірусу гепатиту В або вірусу гепатиту С
- Будь-яка активна інфекція, з приводу якої пацієнт отримував системну терапію, і клінічно значуще серцево-судинне захворювання
Групи дослідження1
- Пацієнти (N = 1174) були рандомізовані у співвідношенні 2:1 в наступні групи лікування.a,b
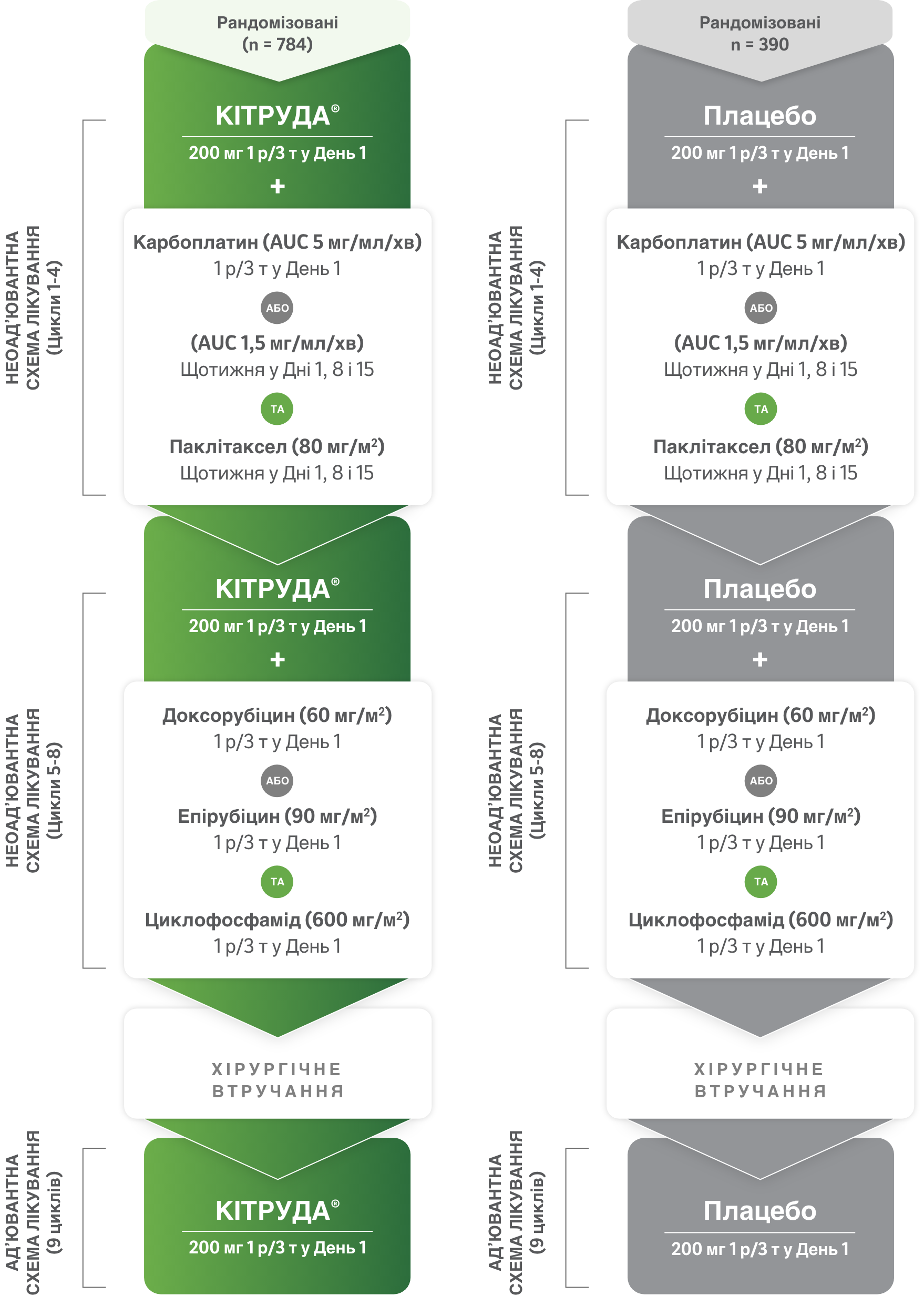
- Лікування препаратом КІТРУДА® або плацебо продовжувалося, поки не завершувався курс лікування або поки не виникало прогресування захворювання, яке перешкоджало виконанню радикального хірургічного втручання, або рецидив захворювання в ад’ювантній фазі, або прояви неприйнятної токсичності.1
Основні показники ефективності1
- пПВ: Відсутність інвазивного раку в грудній залозі і лімфовузлах (ypT0/Tis ypN0) і оцінювалася місцевим патологом в сліпому режимі на час виконання радикального хірургічного втручання.2
- БПВ: Час від рандомізації до будь-якої з наступних подій: прогресування захворювання, яке перешкоджає виконанню хірургічного втручання, місцевий або віддалений рецидив, друге первинне злоякісне захворювання або смерть з будь-якої причини.1
Додаткові показники ефективності1
- Загальна виживаність (ЗВ)
- На час виконання аналізу БПВ дані щодо ЗВ ще були неостаточними.
a Рандомізація була стратифікованою за наявністю ураження лімфовузлів (позитивний або негативний результат), за розміром пухлини (T1/T2 або T3/T4) і за обраною схемою введення карбоплатину (з введенням один раз на 3 тижні або щотижня).2
b Усі досліджувані препарати вводилися внутрішньовенно.2
Умовні скорочення:
1 р/3 т = 1 раз на 3 тижні; AUC = площа під кривою.
Список літератури:
- Schmid P, Cortes J, Pusztai L, et al. Pembrolizumab for early triple-negative breast cancer. N Engl J Med. 2020;382(9):810–821. doi:10.1056/ nejmoa1910549
- Schmid P, Cortes J, Dent R, et al. Event-free survival with pembrolizumab in early triple negative breast cancer. N Engl J Med. 2022;386(6):556–567. doi:10.1056/nejmoa2112651
Портрет Пацієнта
Вихідні характеристики учасників дослідження, які отримували препарат КІТРУДА® + хіміотерапія
- У дослідженні KEYNOTE-522 75,3% пацієнтів мали захворювання стадії II; 24,7% пацієнтів мали захворювання стадії III.1
- Медіана віку: 49 років (діапазон: 22-80).1
- У 86,5% пацієнтів ФС за шкалою ECOG був на рівні 0 балів; у 13,5% пацієнтів ФС за шкалою ECOG був на рівні 1 балу.1
- У 55,9% пацієнтів ще не настала менопауза; у 44% вже настала менопауза.1
Розмір пухлини і ураження лімфовузлів
У дослідженні KEYNOTE-522 пацієнти могли брати участь, якщо у них була пухлина розміром > 1 см, але ≤ 2 см у діаметрі разом із ураженням лімфовузлів або якщо у них була пухлина розміром > 2 см у діаметрі незалежно від наявності ураження лімфовузлів.1

Портрет пацієнта

Оцінка2
Загальний медичний огляд: Пальпується об’ємне утворення у лівій грудній залозі2
Діагностична двостороння мамограма: Об’ємне утворення з нечітким контуром розміром 2,1 см у верхньому зовнішньому квадранті лівої грудної залози, яке відповідає пропальпованому об’ємному утворенню2
Ультразвукове обстеження: об’ємне утворення неправильної форми розміром 2,1 см, яке відповідає аномальному утворенню, виявленому на мамограмі; жодних підозрілих пахвових лімфовузлів не помічено2
Трепан-біопсія пухлини: Інвазивна протокова карцинома ступеня злоякісності 32
Результати оцінки біомаркерів: ER/PR-негативний; HER2-негативний2
ПЕТ/КТ-сканування: Відсутність віддалених метастазів2
Мультигенна панель: Відсутність несприятливих мутацій2
ФС за шкалою ECOG: 02
Співпрацюйте з усіма членами мультидисціплінарної команди для визначення можливості використання препарату Кітруда для лікування пацієнтів з ранніми стадіями ТНРГЗ високого ризику3
Умовні скорочення:
ІМТ = індекс маси тіла; ER = рецептор естрогену, PR = рецептор прогестерону, HER2 = рецептор епідермального фактору росту людини 2 типу, ПЕТ = позитронно-емісійна томографія, КТ = комп’ютерна томографія.
Список літератури:
- Schmid P, Cortes J, Pusztai L, et al. Pembrolizumab for early triple-negative breast cancer. N Engl J Med. 2020;382(9):810–821. doi:10.1056/ nejmoa1910549
- Інструкція для медичного застосування лікарського засобу Кітруда. PП UA/16209/01/01
- Schmid P, Cortes J, Dent R, et al. Event-free survival with pembrolizumab in early triple negative breast cancer. N Engl J Med. 2022;386(6):556–567. doi:10.1056/nejmoa2112651.
Вибрана інформація з безпечності (SSI)
КІТРУДА®
Склад: діюча речовина: pembrolizumab; 1 мл концентрату містить 25 мг пембролізумабу; 1 флакон (4 мл) концентрату містить 100 мг пембролізумабу. Допоміжні речовини: L-гістидин, L-гістидин моногідрохлорид моногідрат, полісорбат 80, сахароза, вода для ін’єкцій. Протипоказання. Тяжка гіперчутливість до діючої речовини (пембролізумаб) або будь-якої допоміжної речовини препарату. Взаємодія з іншими лікарськими засобами та інші види взаємодій. Офіційні дослідження фармакокінетичної взаємодії інших лікарських засобів із пембролізумабом не проводилися. Оскільки пембролізумаб виводиться з системи кровообігу шляхом катаболізму, метаболічні взаємодії з іншими препаратами не очікуються. Слід уникати застосування системних кортикостероїдів або імуносупресорів перед початком лікування пембролізумабом з причини потенційного впливу на фармакодинамічну активність і ефективність пембролізумабу. Проте системні кортикостероїди або інші імуносупресори можна призначати після початку застосування пембролізумабу для лікування імунозалежних побічних реакцій. Кортикостероїди також можуть бути використані як премедикація, коли препарат Кітруда® застосовують у комбінації з хіміотерапією, для профілактики блювання та/або для полегшення побічних реакцій, пов’язаних з хіміотерапією. Передозування. Немає інформації про передозування пембролізумабу. У разі передозування слід ретельно спостерігати за станом пацієнта щодо виникнення ознак або симптомів побічних реакцій та розпочати відповідне симптоматичне лікування. Побічні реакції. Імуноопосередковані побічні реакції, які можуть бути тяжкими або летальними, можуть виникати в будь-якій системі органів або тканинах і вражати більше ніж одну системи організму одночасно. Імуноопосередковані побічні реакції можуть виникнути в будь-який час після початку лікування антитілами, що блокують PD-1/PD-L1. Препарат Кітруда® може бути причиною розвитку: імуноопосередкованого пневмоніту, імуноопосередкованого коліту, гепатотоксичності та імуноопосередкованого гепатиту, імуноопосередкованих ендокринопатій (наднирковозалозної недостатності, гіпофізиту, порушень функції щитовидної залози, цукрового діабету 1 типу), імуноопосередкованого нефриту і порушення функції нирок, імуноопосередкованих дерматологічних побічних реакцій. Побічні реакції, пов’язані з проведенням інфузії: Препарат Кітруда® може бути причиною розвитку тяжких або загрозливих для життя побічних реакцій, пов’язаних з проведенням інфузії, включаючи гіперчутливість і анафілаксію, про що повідомлялося у 0,2 % із 2799 пацієнтів, які отримували цей лікарський засіб. Слід спостерігати за станом пацієнтів стосовно появи ознак та симптомів побічних реакцій, пов’язаних з проведенням інфузії, таких як озноб, свистяче дихання, свербіж, гіперемія, висип, гіпотензія, гіпоксемія і лихоманка. Потрібно припинити або уповільнити швидкість інфузії у разі легких (1 ступінь) або помірних (2 ступінь) реакцій, пов’язаних з інфузією. У разі розвитку тяжких (3 ступінь) чи загрозливих для життя (4 ступінь) побічних реакцій, пов’язаних з проведенням інфузії, інфузію слід припинити і остаточно відмінити препарат Кітруда®. Застосування у період вагітності або годування груддю.
Вагітність
Резюме ризиків
З огляду на механізм дії препарат Кітруда® може негативно впливати на плід при застосуванні вагітним жінкам. Немає доступних даних для людини щодо ризику ембріофетальної токсичності. У моделях на тваринах сигнальний шлях PD-1/PD-L1 був важливим для збереження вагітності за допомогою індукції материнської імунної толерантності до тканин плода. Відомо, що імуноглобулін людини IgG4 (імуноглобуліни) проникають через плаценту; тому можлива передача пембролізумабу від матері до плода, що розвивається. Необхідно консультувати вагітних жінок щодо потенційного ризику для плода. У загальній популяції США оцінений вихідний ризик розвитку серйозних вроджених вад і невиношування вагітності при клінічно підтвердженій вагітності становить 2–4 % і 15–20 % відповідно.
Дані
Дані досліджень на тваринах
Дослідження репродуктивної токсичності на тваринах не проводили з препаратом Кітруда® для оцінки його впливу на розмноження клітин та розвиток плода. Оцінка впливу шляху PD-1 на репродуктивну функцію на основі опублікованих даних показала, що центральною функцією шляху PD-1/PD-L1 є збереження вагітності шляхом підтримання імунної толерантності матері до плода. На моделі вагітності у мишей було показано блокаду сигнального шляху PD-L1, що порушує толерантність до плода і призводить до збільшення випадків втрати плода; отже, потенційні ризики застосування препарату Кітруда® під час вагітності включають підвищену частоту абортів або мертвонародження. Як повідомлялося в публікаціях, не спостерігалося вад розвитку, пов’язаних з блокадою сигнального шляху PD-1, у потомства цих тварин; однак імуноопосередковані розлади відбувалися у PD-1- нокаутних мишей. З огляду на механізм дії вплив пембролізумабу на плід може збільшити ризик розвитку імуноопосередкованих розладів або зміни нормальної імунної відповіді.
Годування груддю
Немає даних щодо наявності пембролізумабу в грудному молоці ні в тварин, ні у людини, як і інформації щодо його впливу на дитину, яку годують груддю, та на продукування молока. IgG матері, як відомо, наявний у грудному молоці. Наслідки місцевого впливу на шлунковокишковий тракт та обмеженого системного впливу препарату Кітруда® на дитину, яка знаходиться на грудному вигодовуванні, невідомі. У зв’язку з можливістю виникнення серйозних побічних реакцій у дітей, яких годують груддю, жінкам рекомендується не годувати груддю під час лікування препаратом Кітруда® та протягом 4 місяців після введення останньої дози.
Репродуктивний потенціал жінок та чоловіків
Тесm на вагіmнісmь
Жінкам репродуктивного віку слід зробити тест на вагітність перед початком лікування препаратом Кітруда® (див. підрозділ «Вагітність»).
Контрацепція
Кітруда® може завдати шкоди плоду при введенні вагітній жінці (див. розділ «Особливості застосування», підрозділ «Вагітність»). Жінкам репродуктивного віку рекомендується використовувати ефективну контрацепцію під час лікування препаратом Кітруда® та протягом 4 місяців після введення останньої дози. Ембріофетальна токсичність: з огляду на механізм дії препарат Кітруда® може негативно впливати на плід при застосуванні вагітним жінкам. Необхідно проконсультувати жінку щодо потенційного ризику для плода. Слід проконсультувати жінку репродуктивного віку щодо використання високоефективних засобів контрацепції у період лікування препаратом Кітруда® і протягом 4 місяців після введення останньої дози. Діти. Безпеку та ефективність препарату Кітруда® як монотерапії встановлено для дітей з меланомою, cHL, PMBCL, MCC, пухлиною з MSI-H та раком з TMB-H. Застосування препарату Кітруда® дітям за цими показаннями підтверджено доказами належного рівня і добре контрольованих досліджень застосування препарату Кітруда® дорослим з додатковими даними фармакокінетики та безпеки у дітей. Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами. Пембролізумаб може мінімально впливати на здатність керувати транспортним засобом і користуватися іншими механізмами. Після застосування пембролізумабу повідомлялося про втому. Виробник. Мерк Шарп і Доум Б.В., Нідерланди/Merck Sharp & Dohme B.V., the Netherlands. Місцезнаходження виробника та адреса місця провадження його діяльності. Ваардервег 39, 2031 БН Хаарлем, Нідерланди/Waarderweg 39, 2031 BN Haarlem, the Netherlands. Реєстраційне посвідчення: UA/16209/01/01. Зміни затверджено Наказом МОЗ України No467 від 19.03.2024. Термін дії РП: 02.07.2022 по 02.07.2027.
Для перегляду додаткової інформації натисніть тут
Якщо у Вас виникли питання з медичної інформації про продукцію компанії МСД, напишіть нам на dpoc.ukraine.cis@merck.com
Компанія МСД не рекомендує застосування лікарських засобів інакше, ніж це передбачено в чинній інструкції для медичного застосування
Матеріал призначений виключно для фахівців сфери охорони здоров’я
Для розповсюдження/демонстрації під час спеціалізованих медичних заходів
Перед призначенням лікарського засобу, будь ласка, ознайомтесь з чинною інструкцією для медичного застосування