Рекомендації для пацієнтів
За допомогою ГАРДАСИЛУ® Ви можете знизити ризик зараження ВПЛ у ваших пацієнтів
Ваша рекомендація має значення, тому ми радимо розпочати розмову з пацієнтами про ГАРДАСИЛ®:

ПОЯСНЕННЯ
- Поясніть потенційні ризики, пов’язані з ВПЛ 1
- Повідомте своїм пацієнтам, що ГАРДАСИЛ® може допомогти захистити їх від 4 типів ВПЛ 1
- Поясніть батькам пацієнтів-підлітків, що ВПЛ не обирає за віком або статтю 1

ЗАОХОЧУВАННЯ
- Підкресліть, що вакцинацію ГАРДАСИЛОМ® можна проводити особам як жіночої статі, так і чоловічої статі 2
- Повідомте своїм пацієнтам, що ГАРДАСИЛ® може забезпечити захист від 4 типів ВПЛ 1
- Обговоріть високий рівень ефективності проти певних видів раку, спричинених ВПЛ 2

ДОМОВЛЕНІСТЬ
- Порекомендуйте в цей самий день розпочати серію ін’єкцій для вакцинації
- Одразу заплануйте день введення наступної дози
Використовуйте будь-яку нагоду, щоб порекомендувати вакцинацію проти ВПЛ за допомогою ГАРДАСИЛУ®
Ви відіграєте важливу роль в ухваленні Вашими пацієнтами рішення щодо вакцинації. Не дозволяйте їм втратити можливість отримати захист за допомогою ГАРДАСИЛУ®.
Коли рекомендувати вакцинацію ГАРДАСИЛОМ® дорослим людям?
Обговоріть це питання зі своїми пацієнтами під час їхніх візитів.

Дорослі: жінки
- Регулярні візити до акушера/гінеколога3
- Скринінг раку шийки матки4

Дорослі: жінки та чоловіки
- Обговорення контрацепції4
- Регулярні візити5
- Інші призначені вакцинації для дорослих6
Коли рекомендувати вакцинацію ГАРДАСИЛОМ® батькам дітей і підлітків?
Перед запланованим візитом перевірте, чи батьки Ваших пацієнтів володіють останньою
інформацію про вакцинацію проти ВПЛ, і порекомендуйте її, якщо2:

Діти та підлітки
- Мають вік від 9 років (хлопчики та дівчатка)2
- Заплановано проведення інших вакцинацій2
Література:
- World Health Organization (WHO). Human papillomavirus vaccines: WHO position paper. Wkly Epidemiol Rec.2017;19(92):241-268
- Інструкція для медичного застосування лікарського засобу Гардасил / Gardasil
- Guo F, Hirth JM, Berenson AB. Human papillomavirus vaccination and pap smear uptake among young women in the United States: Role of provider and patient. Journal of Women’s Health. 2017:26(10)1114-1122.
- Workowski KA, Bachmann LH, Chan PA, et al. Sexually Transmitted Infections Treatment Guidelines, 2021. MMWR Morb Mortal Wkly Rep. 2021;70(4)1-192.
- Barrow RY, Ahmed F, Bolan GA, Workowski KA, Recommendations for provided quality sexually transmitted diseases clinical services 2020. MMWR morb mortal WKly Rep 2020; 68 (5)1-20
- WHO, International Travel and Health, Vaccine-preventable diseases and vaccines, 2019 (v1.0)
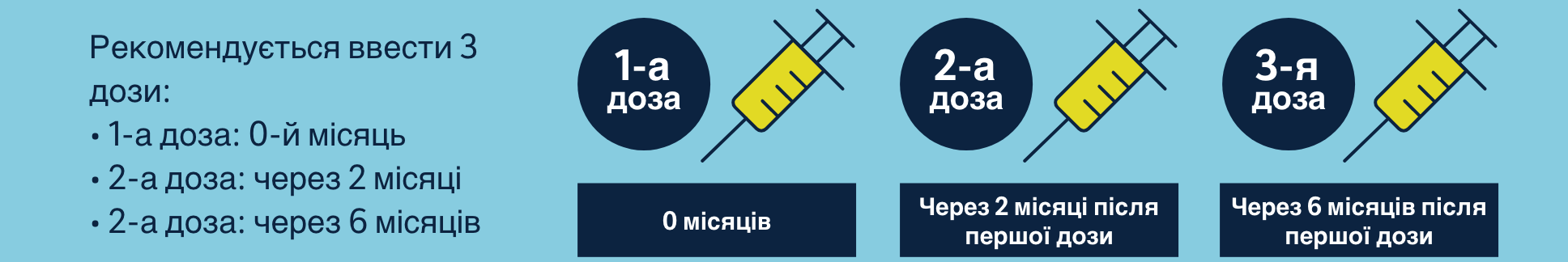
Дозування для дітей та дорослих
Всесвітня організація охорони здоров’я (ВООЗ) визнає захворювання, пов’язані з ВПЛ, як глобальну проблему охорони здоров’я, і рекомендує включити вакцинацію проти ВПЛ у національні програми імунізації.1
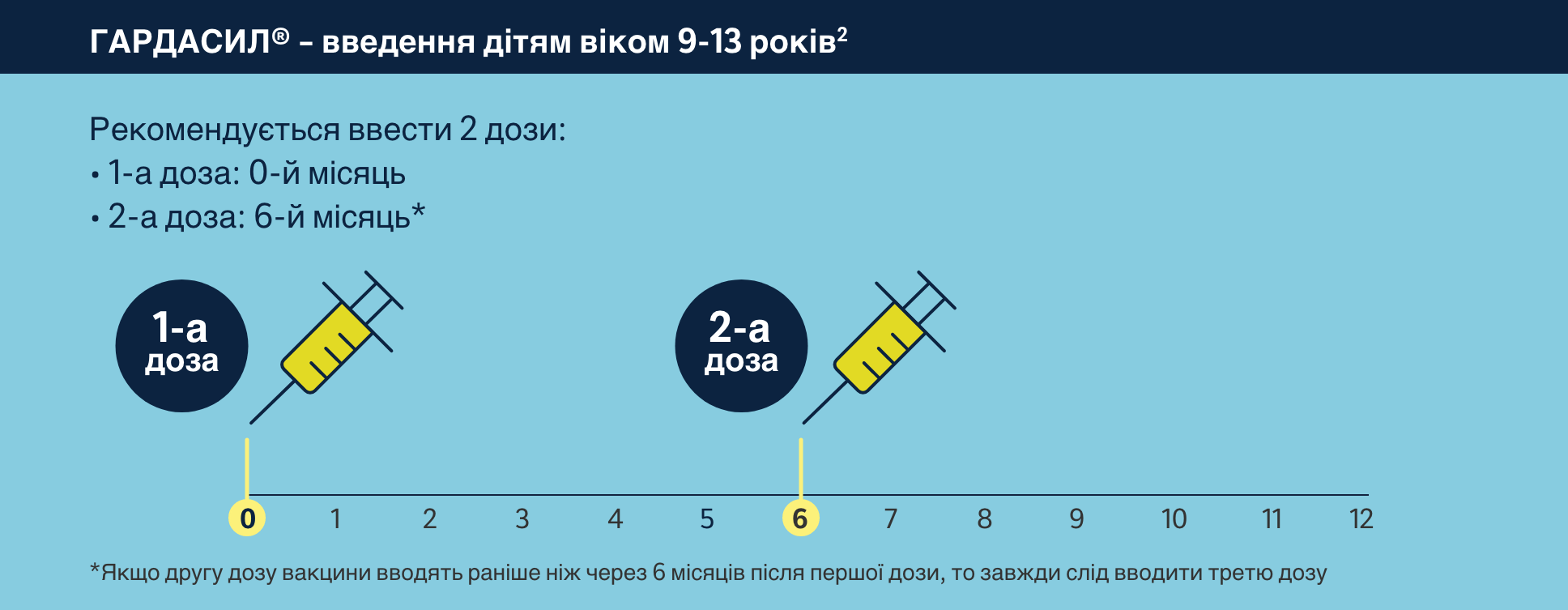
ГАРДАСИЛ® – введення дорослі віком від 14 років
Другу дозу слід вводити принаймні через 1 місяць після першої, а третю – як мінімум через 3 місяці після другої дози.
За умови використання іншого місця для ін’єкції ГАРДАСИЛ® можна вводити одночасно з такими вакцинами2:
Вакцина проти гепатиту В
Вакцина проти дифтерії (d) та правця (T) з вакциною проти кашлюку (ацелюлярний
компонент) [ap] і поліомієліту (інактивована вакцина) [IPV] [вакцини dTap, dT-IPV, dTap-IPV]
Побічні явища після застосування ГАРДАСИЛУ®
У таблиці нижче наводяться побічні реакції, пов’язані з вакциною, які спостерігалися у осіб, яким вводили ГАРДАСИЛ®, з частотою принаймні 1,0%, а також з більшою частотою, ніж у осіб, яким вводили плацебо. Вони класифікуються за частотою при використанні таких категорій:
[дуже часто (≥1/10); часто (від ≥1/100 до <1/10); нечасто (від ≥1/1000 до <1/100); рідко (від ≥1/10000 до <1/1000); дуже рідко (<1/10 000)].
Постмаркетинговий досвід
У цій таблиці також містяться додаткові побічні ефекти, про які спонтанно повідомлялося під час постмаркетингового використання ГАРДАСИЛУ® в усьому світі. Оскільки про ці випадки повідомлялося добровільно у популяції невизначеного розміру, не завжди можна достовірно оцінити їх частоту або встановити причинно-наслідковий зв’язок із впливом вакцини. Тому частота цих побічних явищ кваліфікується як «не відомо».
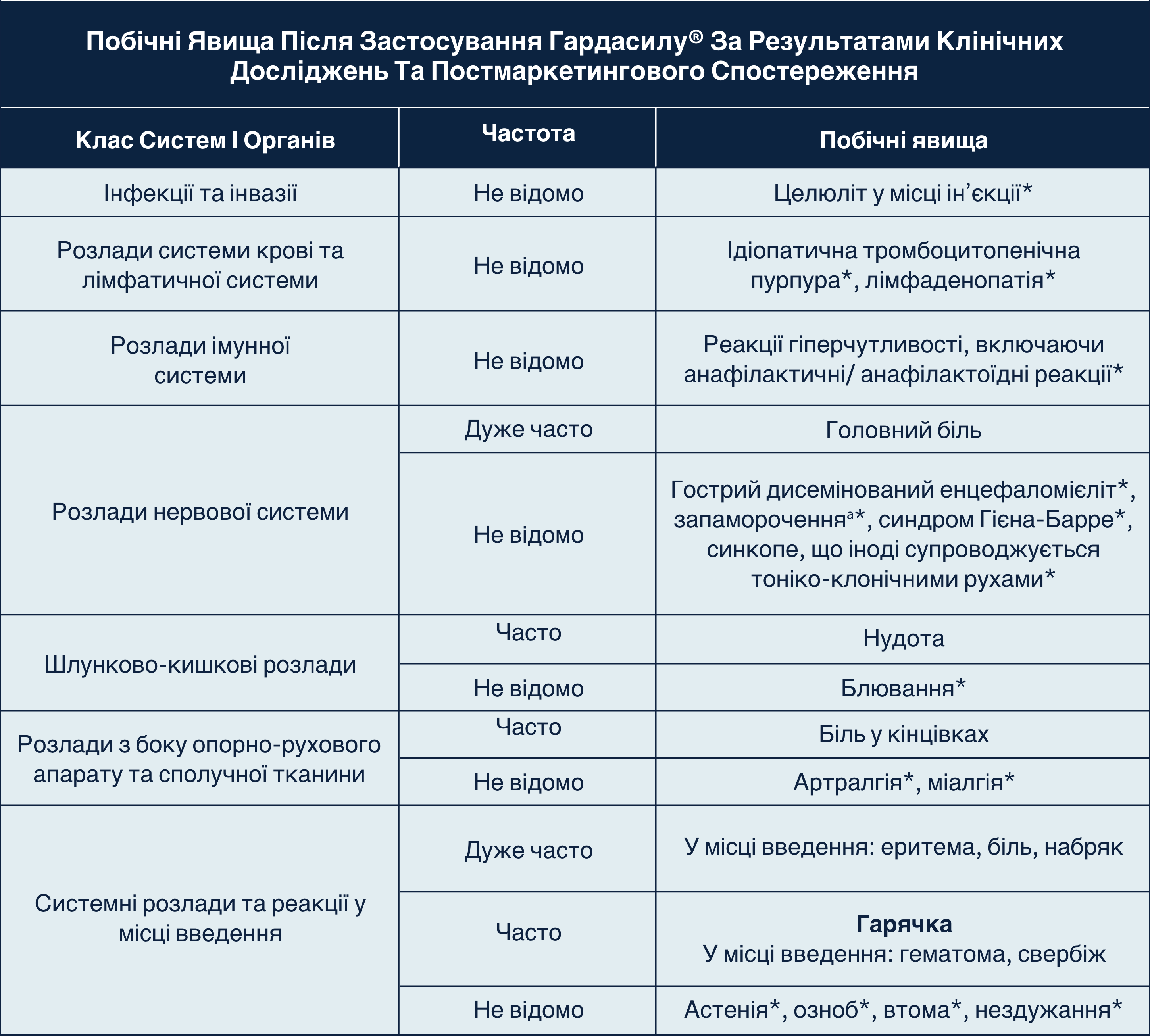
*Постмаркетингові побічні явища (частоту неможливо оцінити на підставі наявних даних).
аПід час клінічних досліджень запаморочення було частою побічною реакцією, яке спостерігалося у жінок. У чоловіків у групі реципієнтів вакцини запаморочення не виникало з більшою частотою, ніж у групі реципієнтів плацебо.
У 7 клінічних дослідженнях (6 плацебо-контрольованих досліджень) учасникам вводили ГАРДАСИЛ® або плацебо в день реєстрації у дослідженні та приблизно через 2 місяці і 6 місяців після цього. Припинили участь у дослідженні через побічні реакції лише декілька осіб (0,2%). Безпеку оцінювали або для всієї досліджуваної популяції (учасники всіх 6 досліджень), або для попередньо визначеної підгрупи досліджуваної популяції (учасники одного дослідження) при використанні картки вакцинації (VRC), яку потрібно було заповнювати протягом 14 днів після кожної ін’єкції ГАРДАСИЛУ® або плацебо. Особи, за якими було проведено спостереження за допомогою картки вакцинації, включали 10088 осіб (6995 жінок віком від 9 до 45 років і 3093 чоловіки віком від 9 до 26 років на момент реєстрації), які отримували ГАРДАСИЛ®, і 7995 осіб (5692 жінки та 2303 чоловіки), які отримували плацебо.2
Особливі застереження при зберіганні ГАРДАСИЛУ®


Зберігання після отримання2
- Зберігайте ГАРДАСИЛ® у холодильнику при температурі від від 2 до 8°С.
- Захищайте від світла.
- Не заморожуйте.
- Зберігайте в недоступному для дітей місці.


Утилізація2
- Після закінчення терміну придатності, зазначеного на упаковці.
- Якщо фізичні властивості суспензії змінилися.
Література:
- World Health Organization. Human papillomavirusvaccines: WHO position paper, May 2017. Wkly Epidemiol Rec. 2017;19(92):241-268
- Інструкція для медичного застосування лікарського засобу Гардасил / Gardasil
Перед застосуванням лікарського засобу, будь ласка, ознайомтесь з чинною інструкцією для медичного застосування. Якщо у Вас виникли питання з медичної інформації про продукцію компанії МСД, напишіть нам на dpoc.ukraine.cis@msd.com.
UA-HPV-00217 | Матеріал затверджений: 08/2025 | Матеріал дійсний до: 08/2027

